
 有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )| A、铜片上有气泡逸出 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、反应前后铜片质量不改变 |
| D、反应中,盐桥中的K+会移向CuSO4溶液 |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
 .试回答:
.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为:O2+2H2O+4e-=4OH- |
| B、粗铜应该与电池中通H2的一极相连 |
| C、放电时CO32- 向正极移动 |
| D、若能量的转化率为100%,电池中产生1 mol 水蒸气,可得纯铜64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如图所示,则两溶液的物质的量浓度分别是( )
向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如图所示,则两溶液的物质的量浓度分别是( )| A | B | C | D | |
| 盐酸的物质的量浓度 mol/L |
0.12 | 0.04 | 0.03 | 0.09 |
| NaOH的物质的量浓度 mol/L |
0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收其中的石墨电极 |
| B、防止电池中渗泄的电解液腐蚀其他物品 |
| C、利用电池外壳的金属材料 |
| D、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| C | Al箔插入稀硝酸中 | 开始无现象 | Al箔表面被硝酸氧化钝化,形成致密的氧化膜 |
| D | 向浓度均为0.1mol?L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 所选试剂 | 离子方程式 |
| NaCl溶液 | Na2CO3 | ||
| Mg粉 | Al 粉 | ||
| FeCl2溶液 | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
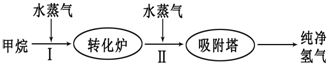

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向逆反应方向移动 |
| C、加入少量 0.1mol?L-1盐酸,溶液中c(H+)减小 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com