
| �ζ���� | ����Һ����MmL | ����KMn04��Һ����MmL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
| ||
| ||
| 19.98+20.02 |
| 2 |


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� |
| B�����������������Һ��Ӧ��Ba2++OH-+H++SO42-=BaSO4��+H2O |
| C������ͨ��ˮ�У�Cl2+H2O=2H++Cl-+ClO- |
| D��������������ͭ��Һ�У�Fe+Cu2+=Fe2++Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ��Һ�У�H+��I-��NO3-��SiO32- |
| B��������ˮ�У�Cl-��NO3-��Na+��SO32- |
| C��������CO2ͨ��ʱ��H+��NH4+��Al3+��SO42- |
| D��������Һ�У�NO3-��I-��Na+��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
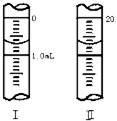 �ڷ�����ѧ�г���Na2C2O4������Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȣ���H2SO4��Һ�У���Ӧ���£�2MnO4-+5C2O42-+16H+
�ڷ�����ѧ�г���Na2C2O4������Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȣ���H2SO4��Һ�У���Ӧ���£�2MnO4-+5C2O42-+16H+
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
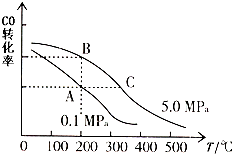 ��һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g���TCH3OH��g����H
��һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g���TCH3OH��g����H�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
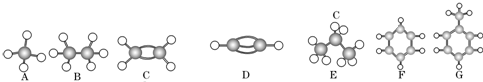
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ʯ���������У�CO32-+2H+=CO2��+H2O |
| B��AlCl3��Һ�м��������ˮ��Al3++3NH3?H2O=Al��OH��3��+3NH4+ |
| C������þ��Һ������������Һ��ϣ�SO42-+Ba2+=BaSO4�� |
| D���Ȼ�����Һ�м���ͭƬ��Fe3++Cu=Fe2++Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH-����c��SO42-����c��H+�� |
| B��0.1mol/L��KOH��Һ��ͨ���״���µ�CO2����3.36L��������Һ�У�c��K+��+c��H+��=c��CO32-��+c��HCO3-��+c��OH-�� |
| C��0.1mol/L��NaOH��Һ��0.2mol/L��HCN��Һ�������ϣ�������Һ�ʼ��ԣ�c��HCN����c��Na+����c��CN-����c��OH-����c��H+�� |
| D��pH��ͬ��NaOH��Һ��CH3COONa��Һ��Na2CO3��Һ��NaHCO3��Һ��Ũ�ȣ�c��NaOH����c��CH3COONa����c��NaHCO3����c��Na2CO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com