
甲醇是人们开发利用的一种新能源,已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
③CH3OH(l)===CH3OH(g) ΔH3=+37.4 kJ·mol-1
(1)写出表示甲醇燃烧热的热化学方程式:__________________________________________________________
__________________________________________________________。
(2)H2的燃烧热为__________________________________________________________。
(3)二甲醚也是一种新型燃料,1 mol二甲醚蒸气完全燃烧生成CO2和液态水时放出1 455 kJ热量,若1 mol二甲醚和甲醇的混合气体完全燃烧生成CO2和液态水时共放出1 224.9 kJ热量,则混合气体中甲醇和二甲醚的物质的量之比为________。
解析 (1)根据盖斯定律,由①+②+③可得液态甲醇完全燃烧的热化学方程式。书写表示物质燃烧热的热化学方程式时,需注意反应条件为25 ℃、101 kPa,可燃物的化学计量数为1,且产物中H2O为液态。(2)根据燃烧热的定义和反应①的ΔH可计算出H2的燃烧热为285.9 kJ·mol-1。(3)根据盖斯定律,由①+②可得:CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1,设混合气体中甲醇的物质的量分数为n,则n×764.7 kJ·mol-1+(1-n)×1 455 kJ·mol-1=1 224.9 kJ,解得n=1/3,则甲醇和二甲醚的物质的量之比为1∶2。
答案 (1)CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-727.3 kJ·mol-1 (2)285.9 kJ·mol-1 (3)1∶2


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
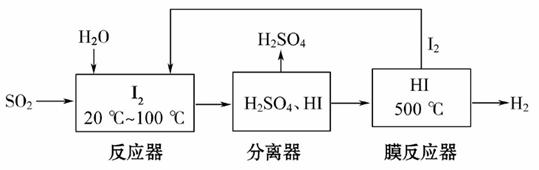
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为
________________________________________。
(2)该循环工艺过程的总反 应方程式为__________________________________。
应方程式为__________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是__________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
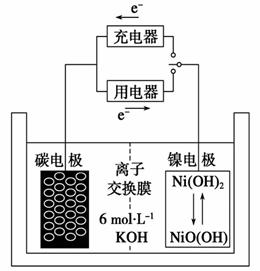
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液由Na+、Ag+、Ba2+、Al3+、
[Al(OH)4]-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是________________________________________。
(2)一定存在的离子是________________________________________________。
(3)生成沉淀乙的离子反应方程式是____________________________________。
(4)写出步骤(C)中产生气体的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是(双选)( )
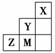
A.离子半径:M->Z2->Y-
B.Z元素形成的氧化物都是共价化合物
C.气态氢化物稳定性,Y>Z>M
D.三种元素中,M的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温常压下,已知:
①4Fe(s)+3O2(g)===2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)===2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是( )
A.ΔH3=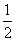 (ΔH1+ΔH2) B.ΔH3=ΔH2-ΔH1
(ΔH1+ΔH2) B.ΔH3=ΔH2-ΔH1
C.ΔH3=2(ΔH1+ΔH2) D.ΔH3=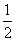 (ΔH2-ΔH1)
(ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气用途十分广泛,可用于生产半导体材料硅,其生产的流程如下,下列说法不正确的是( )石英砂 粗硅
粗硅 四氯化硅
四氯化硅 纯硅.
纯硅.
|
| A. | ①③是置换反应,②是化合反应 |
|
| B. | 高温下,焦炭与氢气的还原性均强于硅 |
|
| C. | 任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
|
| D. | 如果焦炭不足,反应①会释放CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体可能含有HCl、CO2中的一种或两种,若将该气体通过AgNO3溶液,有白色沉淀生成;若将该气体通入少量澄清石灰水,无明显现象.由此可知该气体中( )
|
| A. | 只有HCl,无CO2 | B. | 只有CO2,无HCl |
|
| C. | 一定是HCl和CO2的混合气体 | D. | HCl一定有,CO2无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子中的4个氢原子都可以被取代.若甲烷分子中的4个氢原子都被苯基取代,则可得到的分子如图,对该分子的描述,不正确的是( )
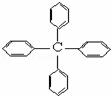
|
| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 |
|
| C. | 此分子属非极性分子 | D. | 此物质属芳香烃类物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com