
 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )| A. | 18、6、4 | B. | 22、8、6 | C. | 26、14、6 | D. | 15、3、1 |
分析 根据原子核外电子排布知识确定原子类别,根据质子数=核外电子数=核电荷数=原子序数以及核外电子的能级排布来回答.
解答 解:A.如x=18,则原子核外各层电子数分别为2、8、8,应为Ar,故A错误;
B.如x=22,则原子核外各层电子数分别为2、8、8、4,最外层最多含有4个电子,故B错误;
C.如x=26,则原子核外各层电子数分别为2、8、14、2,3p轨道含有6个电子,故C正确;
D.若x=15,其核外电子排布为2、8、5,只含有3个电子层,故D错误;
故选C.
点评 本题考查学生原子核外电子排布知识以及原子核外电子的能级排布知识,题目难度不大,注意知识的归纳和整理是关键,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸能测得氯水的pH=4 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| C. | 所有的金属都是固态的 | |
| D. | 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使用溴水鉴别植物油和汽油 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | “玉兔号”月球车上的太阳能电池的材料是硅 | |
| D. | 实验室金属钠失火时,可使用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
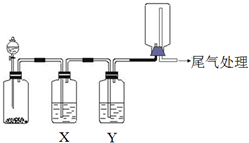
| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)
; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
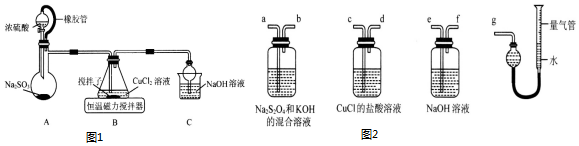
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com