
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式____________________________________________。
(2)写出草酸(H2C2O4)使酸性高锰酸钾褪色的离子方程式__________________________ 。
(3)写出向Na2S2O3 中加入稀硫酸反应的离子方程式______________________________ 。
(4)已知:Se + 2H2SO4(浓) =2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O =Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(5)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。_________________________。
(6)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
【答案】Se + 2HNO3(浓) = H2SeO3 + NO↑ + NO2↑ (或Se + 2HNO3(浓) = H2O + SeO2 + NO↑ + NO2↑) 2MnO4- + 5H2C2O4 + 6H+ = 2Mn2++10CO2↑ + 8H2O S2O32- + 2H+= SO2 ↑+S↓ +H2O H2SO4(浓)﹥SeO2﹥SO2 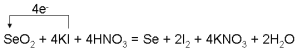 0.925
0.925
【解析】
(1)硒和浓硝酸反应,硒被氧化成+4价的氧化物,硝酸还原为一氧化氮和二氧化氮,生成一氧化氮和二氧化氮的比例为1:1,即二者计量数比为1:1,根据得失电子守恒分析硒的系数为1,所以方程式为:Se+2HNO3(浓)=NO2↑+H2SeO3+NO↑,故答案为:Se + 2HNO3(浓) = H2SeO3 + NO↑ + NO2↑ (或Se + 2HNO3(浓) = H2O + SeO2 + NO↑ + NO2↑);
(2)草酸(H2C2O4)能被酸性高锰酸钾氧化成二氧化碳,所发生的离子反应方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2++10CO2↑+ 8H2O;
(3)向Na2S2O3 中加入稀硫酸会出现淡黄色浑浊,其离子方程式为:S2O32- + 2H+= SO2 ↑+S↓ +H2O;
(4)在氧化还原反应中,氧化剂的氧化性强于氧化产物,所以根据反应Se+2H2SO4(浓)=SeO2+2SO2↑+2H2O得出氧化性H2SO4(浓)>SeO2;在反应SeO2+2SO2+2H2O=Se+4H++2SO42-中,SeO2为氧化剂,SO2为还原剂,则氧化性SeO2>SO2;氧化性由强到弱的顺序为H2SO4(浓)>SeO2>SO2,故答案为:H2SO4(浓)﹥SeO2﹥SO2;
(5)根据化合价分析,二氧化硒中硒的化合价为+4,降低到0,碘的化合价从-1升高到0,所以二氧化硒和碘化钾的比例为1:4,转移4个电子,在根据原子守恒配平其他物质的系数,得方程式,碘转移4个电子给硒,所以电子转移表示为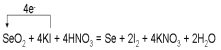 ,故答案为:
,故答案为: ;
;
(4)根据反应方程式可知,SeO2~2I2~4Na2S2O3,消耗硫代硫酸钠的物质的量为0.2000mol/L×0.025L=0.005mol,根据关系式分析样品中二氧化硒的物质的量为0.005mol/4=0.00125mol,其质量为0.00125mol×111g/mol=0.13875g,样品中二氧化硒的质量分数=0.13875g/0.1500g= 0.925;故答案为:0.925。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是( )

A.该固体中一定没有FeCl2,可能含有AlCl3
B.该固体中含有2.70 g Al
C.该固体中含有6.60 g (NH4)2SO4
D.该固体中含有4.75 g MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
D. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
下列说法不正确的是
A. 反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物
B. 反应③符合绿色化学思想
C. 甲基丙烯酸甲酯有两种官能团
D. 反应①是加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com