
 合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.分析 (1)铜原子的核外电子排布为1s22s22p63s23p63d104s1 ,失去一个电子变为正一价铜离子;配合物中提供孤电子对的微粒为配体;
(2)根据中心原子的价层电子对数判断;价电子数和原子数都相同的微粒互为等电子体;
(3)CO(NH2)2•H2O2中含有一个C=O,2个C-N,4个N-H,1个O-O,2个O-H,单键中含有一个σ键,双键中含有一个σ键和一个π键;
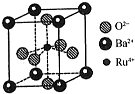
(4)a.六个面心上的O2-与中心的Ru4+形成正八面体结构;
b.根据晶胞结构图可知,与Ba2+紧邻的O2-分布在与钡离子相连的面的面心上,这样的面共有12个;
c.与每个O2-紧邻的Ru4+有2个;
d.利用均摊法计算化学式.
解答 解:(1)铜原子的核外电子排布为1s22s22p63s23p63d104s1 故一价铜离子的核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;配合物中提供孤电子对的微粒为配体,则CH3COO[Cu(NH3)3•CO]中配体为CO和NH3;
故答案为:1s22s22p63s23p63d10或[Ar]3d10;CO和NH3;
(2)NH4NO3中铵根离子中N原子的价层电子对数=4+$\frac{1}{2}$(5-1+4×1)=4,则杂化类型为sp3,NO3-中N原子的价层电子对数=3+$\frac{1}{2}$(5+1-3×2)=3,则杂化类型为sp2,NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体;
故答案为:sp3、sp2;SO3;
(3)CO(NH2)2•H2O2中含有一个C=O,2个C-N,4个N-H,1个O-O,2个O-H,单键中含有一个σ键,双键中含有一个σ键和一个π键,所以1mol CO(NH2)2•H2O2(过氧化尿素)中含有σ键的数目为10NA;
故答案为:10NA;
(4)a.六个面心上的O2-与中心的Ru4+形成正八面体结构,所以晶胞中存在“RuO62-”正八面体结构,故a正确;
b.根据晶胞结构图可知,与Ba2+紧邻的O2-分布在与钡离子相连的面的面心上,Ba2+与相紧邻O2-有3×8×$\frac{1}{2}$=12个,故b正确;
c.由图可知,Ru4+在晶胞中心,O2-在晶胞面心上,与每个O2-紧邻的Ru4+有2个,故c错误;
d.晶胞中Ba2+数目为8×$\frac{1}{8}$=1,Ru4+的数目为1,O2-数目为6×$\frac{1}{2}$=3,所以晶胞的化学式为BaRuO3,故d正确;
故答案为:abd.
点评 本题考查物质结构和性质,涉及电子排布式、微粒空间构型判断、原子杂化方式判断、晶胞计算等知识点,利用价层电子对互斥理论、构造原理等知识点即可解答,题目难度中等,侧重于考查学生的分析能力和对基础上的综合应用能力.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
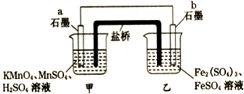
| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
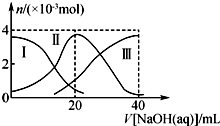 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )| A. | H2A在水中的电离方程式为H2A═H++HA-,HA-?H++A2- | |
| B. | 向NaHA溶液中加水,HA-的电离度增大、溶液的pH减小 | |
| C. | V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 加热时,它很稳定,不发生分解 | ||
| C. | 它能跟碱发生反应 | D. | 它可由PH3和HI化合而成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com