
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
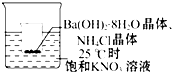 把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.
把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| D. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | 在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3- | |
| C. | NaHCO3与少量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L的Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 试剂 | 分离方法 |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 重结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com