
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是_____、 ____,这些现象分别说明SO2具有的性质是____和____。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。(写化学式)
【答案】分液漏斗 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O 溶液由紫红色变为无色 出现黄色浑浊 还原性 氧化性 待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色 NaOH
【解析】
实验目的是探究SO2的性质,A装置为制气装置,B装置验证SO2的还原性,C装置验证SO2的氧化性,D装置验证SO2的漂白性,据此分析;
(1)A装置盛放浓硫酸的仪器是分液漏斗;根据所加药品,装置A为制气装置,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)酸性高锰酸钾溶液显紫红色,具有强氧化性,如果颜色褪去,体现SO2的还原性,SO2和Na2S发生反应,生成硫单质,体现SO2的氧化性;答案是溶液紫红色褪去,出现黄色沉淀,还原性,氧化性;
(3)SO2能够使品红溶液褪色,体现SO2的漂白性,加热后,溶液恢复为红色,探究SO2与品红作用的可逆性,具体操作是待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)SO2有毒气体,为防止污染环境,需要尾气处理,SO2属于酸性氧化物,采用碱液吸收,一般用NaOH溶液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是()
A.NH4HCO3溶液与过量KOH浓溶液共热:![]() + OH-
+ OH-![]() NH3↑+ H2O
NH3↑+ H2O
B.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2++ OH- + H+ +![]() = BaS04↓+ H2O
= BaS04↓+ H2O
C.醋酸铅溶液通入硫化氢气体的反应:Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
D.向NaAlO2溶液中通入过量CO2:2![]() + CO2 + 3H2O = 2Al(OH)3↓+
+ CO2 + 3H2O = 2Al(OH)3↓+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl3全部制成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________NA(选填“大于”“等于”“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
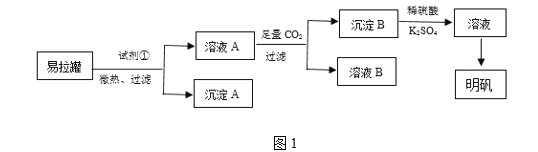
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
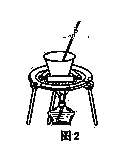
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.氯气溶于水制备次氯酸:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:5 H2O2+2MnO4-+6H+ === 5O2↑+2Mn2++8H2O
C.向澄清石灰水中加入少量的NaHCO3溶液产生沉淀:Ca2++OH-+HCO3-=== CaCO3↓+H2O
D.用铜做电极电解NaCl溶液制备氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v (PCl3) = 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3) = 0.11 mol·L-1,则反应的ΔH < 0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正) < v (逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl5,达到平衡时PCl5的转化率小于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的化学方程式或离子方程式:
(1)Na和H2O反应的离子方程式___________________ ;
(2) Al2O3和NaOH反应的离子方程式___________________ ;
(3)Al和NaOH溶液反应的离子方程式___________________ ;
(4)Na2O2和CO2反应的化学方程式___________________ ;
(5) NaHCO3受热分解的化学方程式___________________ ;
(6)Fe与水蒸气在高温下反应化学方程式___________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室做了4个实验:将对应图象的序号写在实验变化情况后的横线上:
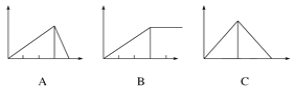
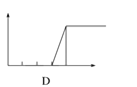
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况 ______,并写出相关的离子方程式_____________.
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________,写出AlCl3溶液与过量NaOH溶液的离子方程式____________.
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况 _____ .
(4)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com