
【题目】下列图示与对应的叙述相符的是( )
A.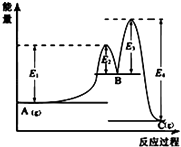 图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
B.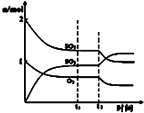 图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.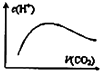 图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.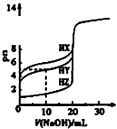 图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
【答案】C
【解析】解:A.整个反应中△H=(E1﹣E2)+(E2﹣E3)﹣E4=E1﹣E3﹣E4 , 故A错误;B.如果t2时扩大容器的体积,则各种物质的浓度瞬间变小,浓度曲线不是连续的,故B错误;
C.NaOH溶液呈碱性对水的电离起抑制作用,水电离氢离子浓度较小,通入二氧化碳,氢氧化钠的浓度减小,对水的抑制程度较小,水电离的氢离子浓度增大,当二氧化碳过量时,二氧化碳与水反应生成碳酸又抑制水的电离,水电离的氢离子浓度减小,与图象相符合,故C正确;
D.氢氧化钠体积为0时,0.1000molL﹣1的三种酸HX、HY、HZ的PH分别约为4、2.5、1,故酸性大小为HX<HY<HZ,故D错误;
故选C.
【考点精析】本题主要考查了反应热和焓变和化学平衡状态本质及特征的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )
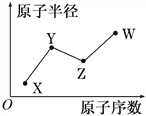
A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. 简单离子的半径由大到小顺序是W->Y3->X+
D. W的单质有强氧化性,可与水发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( ) 
A.可以选用方案Ⅰ分离NaCl中的I2
B.方案Ⅰ中X物质不可能是受热易分解的物质
C.方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D.方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A. 反应剧烈程度:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
序号 | 电解质 | 酸 | 氧化物 | 单质 | 酸性氧化物 |
A | Cl2 | FeBr2 | CO | Hg(汞) | FeCl3 |
B | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
C | KClO3 | HCl | CaO | Cl2 | CO2 |
D | K2O | HCl(浓) | H2O | Cl2 | MnO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种原子序数依次增大的短周期主族元素.已知A与D同主族且能形成离子化合物DA,B元素氢化物的水溶液呈碱性,C与E同主族且EC2是一种具有刺激性气味的气体.用化学用语回答下列问题:
(1)元素F在周期表中的位置 .
(2)C、D、E三种元素原子半径由大到小的顺序为 . A、C、D三种元素组成的化合物和单质F反应的离子方程式为 .
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 .
(4)已知0.50mol EC2被C2氧化成气态EC3 , 放出49.15kJ热量,其热化学方程式为 .
(5)A、B、C以原子个数比4:2:3所形成的化合物,所含的化学键类型为;0.1molL﹣1的该化合物水溶液中的离子浓度由大到小的顺序为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的酸性溶液中,可大量共存的溶液是 ( )
A. Cu2+、Ca2+、Cl、NO3B. Mg2+、SO42-、NH4+、Cl-
C. K+、Na+、HCO3-、Cl-D. K+、MnO4、Cl、S2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com