
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
分析 A.1L蒸馏水为溶剂的体积;
B.托盘天平的感量为0.1g;
C.常温常压下,Vm≠22.4L/mol,n=$\frac{V}{Vm}$、c=$\frac{n}{V}$;
D.稀释前后溶质的物质的量不变.
解答 解:A.1L蒸馏水为溶剂的体积,溶液体积未知,不能计算浓度,故A错误;
B.托盘天平的感量为0.1g,不能称量5.85gNaCl,故B错误;
C.常温常压下,Vm≠22.4L/mol,不能由n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算浓度,故C错误;
D.稀释前后溶质的物质的量不变,则250mL溶液的浓度c=$\frac{0.05L×0.5mol/L}{0.25L}$=0.1mol/L,故D正确;
故选D.
点评 本题考查溶液配制实验的评价,为高频考点,把握物质的量浓度、体积、物质的量的关系为解答的关键,侧重分析与实验能力的考查,注意实验数据及实验评价性分析,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
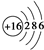 .
. ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
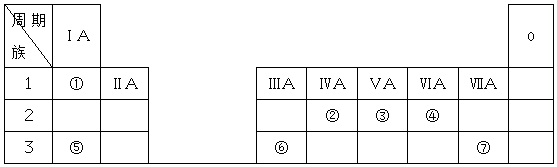
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com