
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
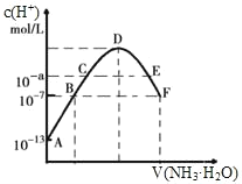
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
【答案】酸性 E>D>A = A D NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的沉淀溶解平衡正向移动 猜想1
【解析】
(1) ①未加入氨水前,溶液的水电离出的OH-浓度为10-13mol/L,所以溶液中c(H+)=0.1mol/L,该酸的浓度为0.05mol/L,所以该酸为二元强酸;
②酸、碱对水的电离起抑制作用,可水解的盐对水的电离起促进作用,随着氨水的不断滴入,溶液中水电离的c(H+)逐渐增大,当两者恰好完全反应生成(NH4)2B时水的电离程度达最大(图中D点),继续加入氨水,水电离的c(H+)逐渐减小;
③溶液中的电荷守恒,可得到答案;
(2)(3)根据已知数据,求出两种物质的物质的量,可确定反应是否完全,再结合Ksp的大小,可判断出沉淀转化的本质,是由Ksp的大小引起的,还是发生其它反应生成的;沉淀的溶解要根据物质的性质来确定,Mg(OH)2属于弱碱,能够与NH4+水解生成的H+发生中和反应而溶解,也能够与NH4+发生复分解反应,生成弱电解质NH3·H2O而溶解,要验证溶解的原因,可用含NH4+的中性溶液做对比实验。
(1) ①NaHB属于强酸的酸式盐,NaHB溶液应该呈酸性,故答案为:酸性;
②向酸溶液中逐渐加入碱发生中和反应,混合液溶液的pH是逐渐增大的,而A显酸性,最小,pH由大到小为E>D>A,故答案为E>D>A;
③D.F点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)=1×10-7mol/L,溶液中H+全部来自水电离,则F点水溶液呈中性,此时溶液中的电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(B2-),因c(H+)=c(OH-),所以有c(NH4+)=2c(B2-),故答案为:=;
(2) ①已知n(MgCl2)=1×10-3L×0.1mol/L=1×10-4mol,n(NaOH)≈0.1×10-3L×2mol/L=2×10-4mol,由反应Mg2++2OH-=Mg(OH)2↓可知,二者基本反应完全,生成白色沉淀Mg(OH)2,当向其中加入FeCl3溶液时,由于Ksp[Fe(OH)3]=4.0×10-38远小于Ksp[Mg(OH)2]=1.8×10-11,所以白色沉淀Mg(OH)2转化为红褐色沉淀Fe(OH)3,故答案选A;当向其中加入NH4Cl溶液,NH4+与Mg(OH)2电离出的OH-结合生成弱电解质NH3·H2O,使Mg(OH)2的溶解平衡正向移动,最终使Mg(OH)2完全溶解得无色溶液,所以答案选D;
②NH4Cl因水解而呈酸性,生成的H+与Mg(OH)2电离出OH-结合生成水,使Mg(OH)2的溶解平衡正向移动,故答案为:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的沉淀溶解平衡正向移动;
(3)由于醋酸铵溶液(pH=7)呈中性,能使Mg(OH)2沉淀溶解,说明不是NH4+水解呈酸性导致Mg(OH)2溶解;当加入弱碱性的NH4Cl和氨水混合液(pH=8)时,沉淀也溶解,说明猜想2是错误的。因此证明Mg(OH)2沉淀溶解的根本原因是NH4+与Mg(OH)2电离出OH-结合生成弱电解质NH3·H2O,促进Mg(OH)2溶解平衡正向移动,最终得无色溶液,所以猜想1是正确的,故答案为:猜想1。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示。
已知:室温下,①2NO+Na2O2=2NaNO2
②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
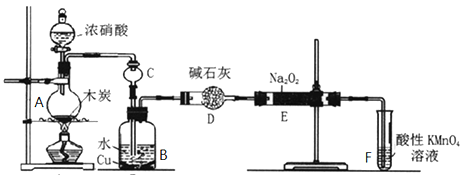
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物__________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 mL,取出25 mL溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
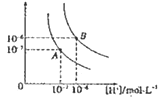
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
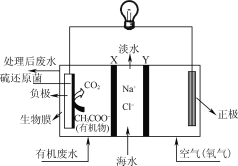
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
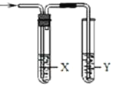
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
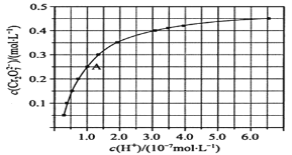
(1)CrO42-和Cr2O72-在溶液中相互转化的离子方程式___。
(2)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__。
(3)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不盛”。青矾厂气是![]() 和
和![]()
B.杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
C.“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾”,其中涉及的操作有结晶
D.推广使用煤液化技术可以减少温室气体二氧化碳的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com