
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:

(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
【答案】10-12mol2/L2 水的电离是吸热过程,升高温度,Kw增大 否 盐酸中氢离子浓度不等于氢氧根浓度 2×10-9mol/L
【解析】
(1)c(H+).c(OH-)=Kw,水的电离是吸热反应,升高温度促进电离;
(2)100℃时,若向溶液中滴加盐酸,溶液中c(H+)增大,c(OH-)减小,溶液中c(H+)≠c(OH-);
(3)水电离出的氢离子浓度总是等于水电离出的氢氧根浓度。
(1)由图可知,B点Kw=c(H+)=c(OH-)=10-6mol/L,则水的离子积Kw=c(H+)·c(OH-)= 10-6 mol/L×10-6 mol/L =10-12 mol2/L2;水的电离是吸热过程,升高温度促进电离,水的离子积增大,故答案为:10-12 mol2/L2;水的电离是吸热过程,升高温度,Kw增大;
(2)100℃时,若向溶液中滴加盐酸,溶液中c(H+)增大,c(OH-)减小,溶液中c(H+)≠c(OH-),所以不可能处于B点,故答案为:否;盐酸中氢离子浓度不等于氢氧根浓度;
(3)水电离出的氢离子浓度总是等于水电离出的氢氧根浓度,100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)=水电离产生的c(OH-)=![]() =2×10-9mol/L,故答案为:2×10-9mol/L。
=2×10-9mol/L,故答案为:2×10-9mol/L。


科目:高中化学 来源: 题型:
【题目】为除去下列物质中少量的杂质(括号内),请写出所加的试剂或操作,并写出相应的化学方程式:
(1)Na2CO3 固体(NaHCO3):______________,___________________________________。
(2)NaCl溶液中混有少量Na2CO3 :_____________,_______________________________。
(3)铜粉中混有铁粉:______________,_______________________________。
(4)铁粉中混有铝粉:______________,_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子是指具有某些特定功能的高分子材料。功能高分子 P 的合成路线如下:
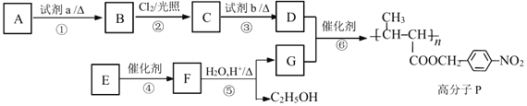
(1)A 是甲苯,试剂 a 是______。反应③的反应类型为______反应。
(2)反应②中 C 的产率往往偏低,其原因可能是______。
(3)反应⑥的化学方程式为______。
(4)E 的分子式是 C6H10O2,其结构简式是______。
(5)吸水大王聚丙烯酸钠![]() 是一种新型功能高分子材料,是“尿不湿”的主要成分。工业上用丙烯(CH2=CH-CH3)为原料来制备聚丙烯酸钠,请把该合成路线补充完整(无机试剂任选)。_________
是一种新型功能高分子材料,是“尿不湿”的主要成分。工业上用丙烯(CH2=CH-CH3)为原料来制备聚丙烯酸钠,请把该合成路线补充完整(无机试剂任选)。_________
(合成路线常用的表达方式为:A![]() B
B![]() ……目标产物)
……目标产物)
CH2=CH-CH3![]() CH2=CH-CH2Cl
CH2=CH-CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
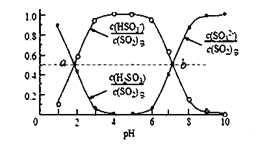
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。
(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
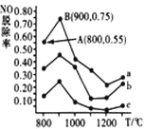
①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
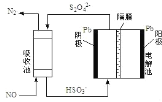
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是
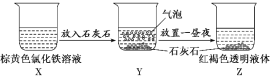
A. X、Z烧杯中分散质相同
B. Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2
C. 利用过滤的方法,可将Z中固体与液体分离
D. Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象,图中所示的实验现象描述正确的是
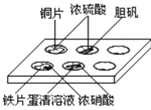
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有蛋清溶液的孔穴中溶液呈黄色。
A.①B.②③C.①④D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com