
下列说法中,不正确的是(设NA表示阿伏伽德罗常数)
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝
B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解
C.足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子
D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
下列图中的实验方案,能达到实验目的的是( )
实验方案 | 实验目的 | |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
| 制备Fe(OH)2并能较长时间观察其颜色 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
B. 硫酸铝溶液中加入足量氨水:Al3++3OH-=Al(OH)3↓
C. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
D. 碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A. 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA
B. 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA
C. 常温下,1 L 0.1 mol·L–1 CH3COONa溶液中CH3COO-离子数目为0.1 NA
D. 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学卷(解析版) 题型:填空题
氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g)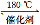 2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
2N2(g)+3H2O(g)ΔH<0。为提高氮氧化物的转化率可采取的措施是(一条即可) 。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)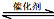 2CO2(g)+N2(g)。ΔH<0
2CO2(g)+N2(g)。ΔH<0
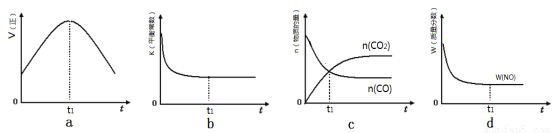
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(4)利用ClO2氧化氮氧化物反应过程如下: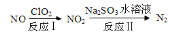
反应Ⅰ的化学方程式是2NO+ClO2+H2O===NO2+HNO3+2HCl,反应Ⅱ的化学方程式是 。若有11.2LN2生成(标准状况),共消耗ClO2 g。
。若有11.2LN2生成(标准状况),共消耗ClO2 g。
(5)工业废气中含有的NO2还可用电解法消除。用NO2为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4然后采用电解法制备N2O5,装置如下图所示。Pt甲为的电极反应式是 。
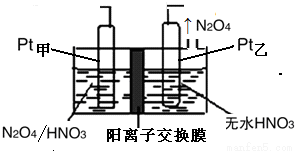
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:实验题
实验室用图示装置制备KClO溶液,再与KOH、F e(NO3)3溶液反应制备高效净水剂K2FeO4。
e(NO3)3溶液反应制备高效净水剂K2FeO4。
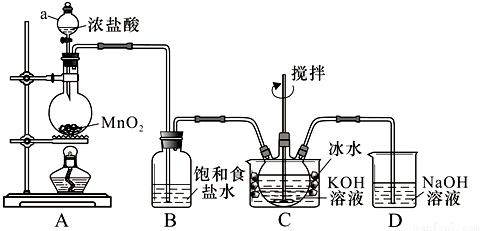
<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称: ;装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO 后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③ 。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀 硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
下列图示与对应的叙述正确的是

A.图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B.图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C.图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D.图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是

A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com