
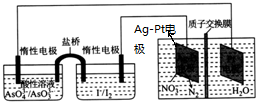
| A. | 电子通过盐桥向正极方向移动 | |
| B. | 电源的正极反应式为AsO43-+2H++2e-═AsO33-+H2O | |
| C. | 导线中流过1 mol e-时,理论上有1.2 mol H+通过质子交换膜 | |
| D. | Ag-Pt电极附近溶液的pH减小 |
分析 左边是原电池,右边是电解池,电解池的左边是NO3-得到电子被还原为N2,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-;
则质子交换膜的左边是阴极,与阴极相连的惰性电极是原电池的负极,是I-失电子被氧化成I2,原电池的正极AsO43-得电子被还原为AsO33-,
A.有盐桥的是原电池,盐桥中是阴离子向负极称动,阳离子向正极移动;
B.原电池为电源,反应中元素化合价变化分析,生成氮气的电极为电解池电解池阴极,连接原电池负极,原电池左侧电极为正极,AsO43-在酸性溶液中被还原为AsO33-;
C.依据电极反应电子守恒计算得到通过质子交换膜的氢离子物质的量;
D.Ag-Pt电极为电解质的阴极,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
解答 解:A.左边是原电池,右边是电解池,盐桥中是阴离子向负极称动,阳离子向正极移动,电子不能通过盐桥,故A错误;
B.原电池为电源,反应中元素化合价变化分析,生成氮气的电极为电解池电解池阴极,连接原电池负极,原电池左侧电极为正极,AsO43-在酸性溶液中被还原为AsO33-,电极反应为:AsO43-+2H++2e-═AsO33-+H2O,故B正确;
C.依据原电池正极电极反应AsO43-+2H++2e-═AsO33-+H2O,导线中流过1 mol e-时,理论上有1 mol H+通过质子交换膜,故C错误;
D.Ag-Pt电极为电解质的阴极,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-,电极附近溶液PH增大,故D错误;
故选B.
点评 本题考查了原电池、电解池原理的分析应用,主要是电极名称、电极反应方程式等知识点,掌握基础是解题关键,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | I-131的原子组成:5378I | B. | HCl电子式: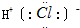 | ||
| C. | Na2S的电子式: | D. | D2O的摩尔质量为:18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6NaOH=2NaClO3+5NaCl+3H2O | |
| B. | CaH2+2H2O=Ca(OH)2+2H2↑ | |
| C. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| D. | 2CuO+Cu2S=4Cu+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由不同原子组成的纯净物一定是化合物 | |
| B. | 一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,则该气体中每个分子含有2个原子 | |
| C. | 含金属元素的离子一定都是阳离子 | |
| D. | 胆矾是混净物,水泥是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 最外层电子数是电子层数的2倍 |
| Z | 元素最高正价是+7价 |
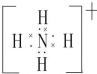 (用元素符号表示).
(用元素符号表示).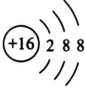 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
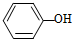
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HSO3-、Cl- | B. | H+、Al3+、Fe3+、I- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、Ba2+、AlO2-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com