
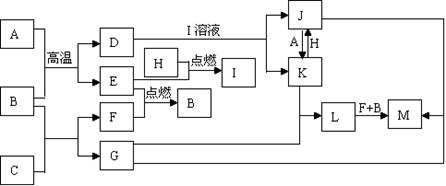
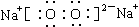 (2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
(2)Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O ;(2)根据离子方程式书写的原则,D Fe3O4与HCl溶液发生反应的离子方程式:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O;(3)Fe(OH)2→Fe(OH)3的化学方程式是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;(4)检验FeCl3中的阳离子时,A.若加入Fe粉 或Al粉等活泼金属单质时,都会使溶液中的Fe3+变为Fe2+,溶液由黄色变为浅绿色。因此不能选择Fe粉来检验,错误。B.加入NaOH溶液,会发生沉淀反应,产生红褐色Fe(OH)3沉淀。可以鉴别。正确。C.加入KSCN溶液,会发生显色反应:Fe3++3SCN—=Fe(SCN)3,溶液变为血红色。因此可以作鉴别试剂。正确。故选项为A。
;(2)根据离子方程式书写的原则,D Fe3O4与HCl溶液发生反应的离子方程式:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O;(3)Fe(OH)2→Fe(OH)3的化学方程式是:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;(4)检验FeCl3中的阳离子时,A.若加入Fe粉 或Al粉等活泼金属单质时,都会使溶液中的Fe3+变为Fe2+,溶液由黄色变为浅绿色。因此不能选择Fe粉来检验,错误。B.加入NaOH溶液,会发生沉淀反应,产生红褐色Fe(OH)3沉淀。可以鉴别。正确。C.加入KSCN溶液,会发生显色反应:Fe3++3SCN—=Fe(SCN)3,溶液变为血红色。因此可以作鉴别试剂。正确。故选项为A。

科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.24mol | B.0.21mol | C.0.25mol | D.0.12mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
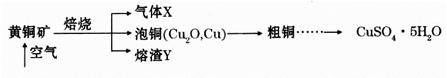


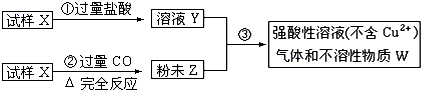
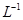 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: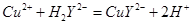 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
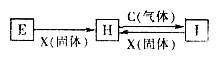
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 |
| C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存 |
| D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
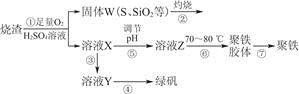
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com