
| A. | 参加反应的Zn质量一定相等 | B. | 硫酸反应完全,CH3COOH有剩余 | ||
| C. | 两种酸都有剩余 | D. | 参加反应的Zn的质量比为3:4 |
分析 各为50mL的H2SO4和CH3COOH两种溶液中,测得c(H+)都等于0.2mol/L,硫酸为强酸,其浓度为0.1molL,而醋酸为弱酸,醋酸的浓度大于0.2mol/L;向两份酸中各加入Zn粉,结果产生H2的体积比为3:4,根据电子守恒,参加反应的锌的质量、物质的量与产生氢气呈正比,所以参加反应的Zn的质量比为3:4;而锌的量不确定,无法判断醋酸、硫酸是否有剩余,据此进行解答.
解答 解:测得c(H+)都等于0.2mol/L,硫酸为强酸,其浓度为0.1molL,而醋酸为弱酸,醋酸的浓度大于0.2mol/L,
根据电子守恒,参加反应的n(Zn)=$\frac{n({H}_{2})×2}{2}$=n(H2),所以参加反应的Zn的质量比为3:4,故A错误、D正确;
由于没有告诉加入锌的量,则无法判断反应后H2SO4和CH3COOH是否都过量,还是硫酸完全反应,醋酸有剩余,故B、C错误;
故选D.
点评 本题考查了化学方程式的计算,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
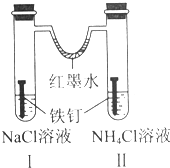
| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到7.8g沉淀 | |
| C. | 最终得到的溶液中只含NaCl溶质 | |
| D. | 最终得到的溶液中c(Na+)=1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液滴入硫酸中:Ba2++SO42-→BaSO4↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+→Cu2++Ag | |
| C. | 醋酸加入氢氧化钠溶液中:H++OH-→H2O | |
| D. | 氯化铁溶液中滴入氢氧化钾溶液:Fe3++3OH-→Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
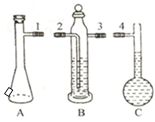 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.| 实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
| 1 | 0.108 | 10.0 | 129.2 | 8.0 |
| 2 | 0.105 | 10.0 | 125.7 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com