

| n |
| V |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++NH3?H2O=H2O+NH4+ |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、将足量CO通过灼热样品,冷却后称量,若固体质量减小,则含有Cu2O |
| B、将干燥的H2通过灼热样品,再通过无水硫酸铜,若无水硫酸铜变蓝,则含有Cu2O |
| C、取少量样品,加入稀硝酸,充分振荡后若观察到溶液呈蓝色,则含有Cu2O |
| D、取少量样品,加入稀硫酸,充分振荡后若观察到溶液呈蓝色,则含有Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 两者在反应中均表现还原性 |
| B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | 铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 | 铁和铝不能与浓硫酸或浓硝酸反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
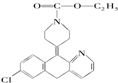 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )| A、该有机物的分子式是C21H22N2O2Cl |
| B、分子中含有四个六元环,其中有一个是苯环 |
| C、1mol分子发生水解反应后能得到2mol新分子 |
| D、1mol分子发生加成反应需要8molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
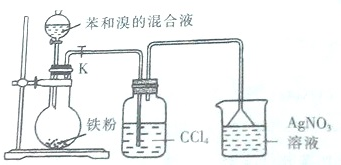
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com