
分析 (1)实验室用二氧化锰与浓盐酸反应制备氯气;
(2)根据氧化还原法配平KMn04、C的系数,再根据元素守恒确定X的化学式;反应中KMn04是氧化剂发生还原反应,被还原;根据电子转移守恒计算生成的氧化物的物质的量;
(3)溶液的PH=8.0,则c(OH-)=10-6mol/L,根据Ksp=c(Mn2+)×c2(OH-)计算.
解答 解:(1)实验室用二氧化锰与浓盐酸反应制备氯气,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)反应中KMnO4→Mn02,Mn元素化合价由+7价降低为+4价,共降低变化3价,C→K2CO3,C元素化合价由0价升高为+4价,共升高4价,化合价升降最小公倍数为12,故KMnO4系数为4,C的系数为3,由C、K的原子数目关系可知K2CO3系数为1,故X含有+4价的C原子、且C原子与K原子之比为1:1,故X为KHCO3;
反应中KMn04是氧化剂发生还原反应,被还原,1molKMn04被还原,氧化产物为KHCO3、K2CO3,每摩尔KHCO3、K2CO3都含1molC原子,令生成的氧化产物为amol,则根据电子转移守恒有1mol×(7-4)=amol×(4-0),解得a=0.75;
故答案为:KHCO3;还原;0.75;
(3)溶液的PH=8.0,则c(OH-)=10-6mol/L,已知Ksp=c(Mn2+)×c2(OH-),则c(Mn2+)=$\frac{2×1{0}^{-13}}{(1{0}^{-6})^{2}}$=0.2 mol/L;
故答案为:0.2 mol/L.
点评 本题考查了氧化还原反应计算、配平、基本概念和溶度积常数的有关计算,题目难度中等,(2)中X的判断为易错点、难点,实质是考查氧化还原反应的配平,侧重于考查学生对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Cu2S是还原产物,反应中1 mol CuSO4失1 mol电子 | |
| B. | 5 mol FeS2发生反应,有10 mol电子转移 | |
| C. | 产物中的SO42-离子有一部分是氧化产物 | |
| D. | FeS2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe2+、SO42-、Cl- | B. | Al3+、Fe3+、I-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
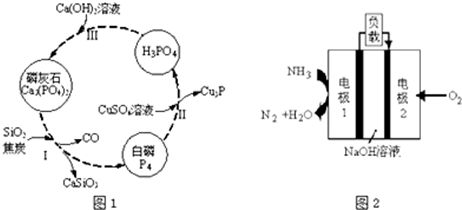
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
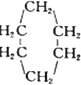 可表示为
可表示为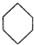 ,下面是某高聚物的合成路线,试完成下列试题:
,下面是某高聚物的合成路线,试完成下列试题: $→_{Ⅰ}^{NH}$
$→_{Ⅰ}^{NH}$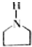 $→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$
$→_{Ⅱ}^{CH=CH}$A$\stackrel{Ⅲ}{→}$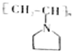
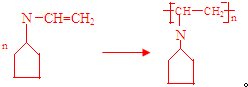 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、AlO2-、Na+ | B. | Na+、CO32-、AlO2- | C. | CO32-、Na+、Al3+ | D. | MnO4-、Na+、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com