
| A. | 4.8×10-3mol | B. | 4.4×10-3mol | C. | 3.2×10-3mol | D. | 2.2×10-3mol |
分析 反应中硝酸起氧化剂与酸的作用,NO3-减少2×10-3mol,说明起氧化剂作用的硝酸为2×10-3mol,根据Cu元素守恒计算硝酸铜的物质的量,再根据硝酸根守恒计算起酸性作用的硝酸,溶液中减少的氢离子的物质的量等于参加反应硝酸的物质的量.
解答 解:反应中硝酸起氧化剂与酸的作用,NO3-减少2×10-3mol,说明起氧化剂作用的硝酸为2×10-3mol,76.8mgCu的物质的量=$\frac{76.8×10{\;}^{-3}g}{64g/mol}$=0.0012mol,则硝酸铜物质的量0.0012mol,由硝酸根守恒离子,其酸性作用的硝酸为0.0012mol×2=0.0024mol,故参加反应硝酸为2×10-3mol+0.0024mol=4.4×10-3mol,故溶液中溶液中H+减少了4.4×10-3mol,
故选B.
点评 本题考查化学方程式有关计算,难度中等,注意利用守恒思想解答,避免判断生成的气体而简化计算.


科目:高中化学 来源: 题型:多选题
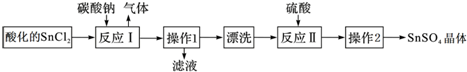
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
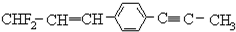 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 12个碳原子不可能都在同一平面上 | |
| B. | 处于同一直线上的原子最多有4个 | |
| C. | 处在同一平面上的原子最多有20个 | |
| D. | 除苯环外的其余碳原子有可能都在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物 | |
| C. | A的氧化物是离子化合物,B的氧化物是共价化合物 | |
| D. | A与C可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 该物质可能含钾元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com