
ЁОЬтФПЁПЮвЙњЕФЁАЩёжнЦпКХЁБдиШЫЗЩДЌвбЗЂЩфГЩЙІЃЌЁАцЯЖ№ЁБЬНдТЙЄГЬвбе§ЪНЦєЖЏЃЎОнПЦбЇМвдЄВтЃЌдТЧђЕФЭСШРжаЮќИНзХЪ§АйЭђЖжЕФ ![]() HeЃЌУПАйЖж
HeЃЌУПАйЖж ![]() HeКЫОлБфЫљЪЭЗХГіЕФФмСПЯрЕБгкФПЧАШЫРрвЛФъЯћКФЕФФмСПЃЎдкЕиЧђЩЯЃЌКЄдЊЫижївЊвд
HeКЫОлБфЫљЪЭЗХГіЕФФмСПЯрЕБгкФПЧАШЫРрвЛФъЯћКФЕФФмСПЃЎдкЕиЧђЩЯЃЌКЄдЊЫижївЊвд ![]() HeЕФаЮЪНДцдкЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
HeЕФаЮЪНДцдкЃЎЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.![]() HeдзгКЫФкКЌга4ИіжЪзг
HeдзгКЫФкКЌга4ИіжЪзг
B.![]() HeКЭ
HeКЭ ![]() HeЛЅЮЊЭЌЮЛЫи
HeЛЅЮЊЭЌЮЛЫи
C.![]() HeдзгКЫФкКЌга3Иіжазг
HeдзгКЫФкКЌга3Иіжазг
D.![]() HeЕФзюЭтВуЕчзгЪ§ЮЊ2ЃЌЫљвд
HeЕФзюЭтВуЕчзгЪ§ЮЊ2ЃЌЫљвд ![]() HeЕФЛЏбЇаджЪЛюЦУ
HeЕФЛЏбЇаджЪЛюЦУ
 AМгН№Ьт ЯЕСаД№АИ
AМгН№Ьт ЯЕСаД№АИ ШЋгХВтЪдОэЯЕСаД№АИ
ШЋгХВтЪдОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтCuCl2КЭNaClЕФЛьКЯШмвКЃЌзюЯШдквѕМЋКЭбєМЋЮіГіЕФЮяжЪЗжБ№ЪЧЃЈ ЃЉ
A.H2КЭCl2B.CuКЭCl2C.H2КЭO2D.CuКЭO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪдкЙтееЬѕМўЯТЃЌПЩвдИњМзЭщЗЂЩњЛЏбЇЗДгІЕФЪЧ( )
A.ТШЦјB.ЯЁбЮЫсC.ЩеМюD.ИпУЬЫсМиШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧ25 ЁцЪБФГаЉШѕЫсЕФЕчРыЦНКтГЃЪ§ЁЃ
ЛЏбЇЪН | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | KaЃН1.8ЁС10Ѓ5 | KaЃН3.0ЁС10Ѓ8 | Ka1ЃН4.1ЁС10Ѓ7 Ka2ЃН5.6ЁС10Ѓ11 | Ka1ЃН5.9ЁС10Ѓ2 Ka2ЃН6.4ЁС10Ѓ5 |
ЃЈ1ЃЉH2C2O4гыКЌЕШЮяжЪЕФСПЕФKOHЕФШмвКЗДгІКѓЫљЕУШмвКГЪЫсадЃЌИУШмвКжаИїРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ_______________________________________ЁЃ
ЃЈ2ЃЉЯђ0.1 molЁЄLЃ1 CH3COOHШмвКжаЕЮМгNaOHШмвКжСcЃЈCH3COOHЃЉЁУcЃЈCH3COOЃЃЉЃН5ЁУ9ЃЌДЫЪБШмвКpHЃН________ЁЃ
ЃЈ3ЃЉЯђЬМЫсФЦШмвКжаЕЮМгЩйСПТШЫЎЕФРызгЗНГЬЪНЮЊ_____________________ЁЃ
ЃЈ4ЃЉШє0.1molЁЄLЃ1CH3COOHШмвКгы0.1molЁЄLЃ1NaOHШмвКЕШЬхЛ§ЛьКЯЃЈКіТдЛьКЯКѓШмвКЬхЛ§ЕФБфЛЏЃЉЃЌВтЕУЛьКЯШмвКЕФpHЃН8ЃЌдђcЃЈNa+ЃЉ-cЃЈCH3COOЃЃЉ=_______________molЁЄLЃ1ЃЈЬюОЋШЗМЦЫуНсЙћЃЉЁЃ
ЃЈ5ЃЉ НЋCH3COOHШмвКгыДѓРэЪЏЗДгІЫљВњЩњЕФБъПіЯТ44.8LЦјЬхШЋВПЭЈШыЕН2L 1.5mol/LЕФNaOHШмвКжаГфЗжЗДгІЃЌдђШмвКжаЫљгаРызгЕФЮяжЪЕФСПХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪєгкКЃЫЎЛЏбЇзЪдДРћгУЕФЪЧЃЈЁЁЁЁЃЉ
A. КЃЫЎЕЛЏ B. РћгУКЃЫЎРфШД C. КЃЫЎЬсфх D. КЃЫЎЗЂЕч
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇЗНГЬЪНИФаДГЩРызгЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
A. CuSO4+Ba(OH)2=Cu(OH)2Ё§+BaSO4Ё§ Cu2++2OHвЛ= Cu(OH)2Ё§
B. CaCO3+2HCl=CaCl2+CO2Ёќ+H2O CO32вЛ+2H+= CO2Ёќ+H2O
C. Ca(NO3)2+Na2CO3=CaCO3Ё§+2NaNO3 Ca2++ CO32вЛ= CaCO3Ё§
D. Ba(OH)2+H2SO4= BaSO4Ё§+2H2O H++OHвЛ=H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪОвтЭМгыЖдгІЕФЗДгІЧщПіе§ШЗЕФЪЧ
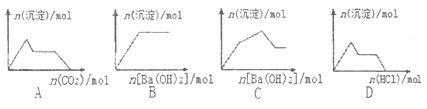
A. КЌ0.01molKOHКЭ0.01molCaЃЈOHЃЉ2ЕФЛьКЯШмвКжаЛКТ§ЭЈШыCO2
B. NaHSO4ШмвКжаж№ЕЮМгШыBaЃЈOHЃЉ2ШмвК
C. KAlЃЈSO4ЃЉ2ШмвКжаж№ЕЮМгШыBaЃЈOHЃЉ2ШмвК
D. Na[AlЃЈOHЃЉ4]ШмвКжаж№ЕЮМгШыбЮЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉФГбЇаЃЪЕбщЪвДгЛЏбЇЪдМСЩЬЕъТђЛи18.4 molЁЄLЃ1ЕФСђЫсЁЃЯжгУИУХЈСђЫсХфжЦ100 mL 1 molЁЄLЃ1ЕФЯЁСђЫсЁЃХфжЦ100 mL 1 molЁЄLЃ1ЕФЯЁСђЫсашвЊгУСПЭВСПШЁЩЯЪіХЈСђЫсЕФЬхЛ§ЮЊ____mL(БЃСєвЛЮЛаЁЪ§)ЃЌСПШЁХЈСђЫсЪБгІбЁгУ________(ЬюзжФИ)ЙцИёЕФСПЭВЁЃ
AЃЎ10 mLЁЁ BЃЎ50 mLЁЁ CЃЎ100 mL
ЃЈ2ЃЉШЁ50 mL Na2CO3ЁЂNa2SO4ЕФЛьКЯШмвКЃЌМгШыЙ§СПЕФBaCl2ШмвККѓЕУ29.02gАзЩЋГСЕэЃЌгУЙ§СПЕФЯЁЯѕЫсДІРэКѓГСЕэСПМѕЩйЕН9.32gЃЌВЂгаЦјЬхЗХГіЁЃЪдМЦЫуЃК
ЂйдЛьКЯЮяжаNa2SO4ЮяжЪЕФСПХЈЖШЮЊ____________ЃЛ
ЂкВњЩњЕФЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ(1)H2O(g) = H2O(l) ІЄH1ЃНЃQ1 kJЁЄmol-1
(2)CH3OH(g) = CH3OH(l) ЁїH2ЃНЃQ2 kJЁЄmol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)ЃЋ4H2O(g) ЁїH3ЃНЃQ3 kJЁЄmol-1
ЃЈQ1ЁЂQ2ЁЂQ3ОљДѓгк0ЃЉШєвЊЪЙ1molвКЬЌМзДМЭъШЋШМЩеЃЌзюКѓЛжИДЕНЪвЮТЃЌЗХГіЕФШШСПЮЊЃЈЕЅЮЛЃКkJЃЉЃЈ ЃЉ
A. Q1+ Q2 + Q3 B. 0.5Q3-Q2+2Q1 C. Q3-2Q2+4Q1 D. 0.5ЃЈQ1+Q2+Q3ЃЉ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com