
| A. | H2S,HCl,PH3的热稳定性由弱到强 | |
| B. | 物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大 | |
| C. | 等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多 | |
| D. | CH3CH2OH,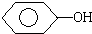 ,CH3COOH的酸性由弱到强 ,CH3COOH的酸性由弱到强 |
分析 A.非金属性越强,对应氢化物越稳定;
B.对应碱的碱性越弱,盐的水解程度越大;
D.等质量的烃,由最简式可知含H越多的消耗氧气越多;
D.乙醇为中性,苯酚显弱酸性,乙酸显酸性,且乙酸与苯酚钠反应生成苯酚.
解答 解:A.非金属性越强,对应氢化物越稳定,则HCl、H2S、PH3的热稳定性由强到弱,故A错误;
B.对应碱的碱性越弱,盐的水解程度越大,且MgCl2、AlCl3水解显酸性,则物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH由大到小,故B错误;
D.等质量的甲烷(CH4)、乙烯(CH2)、乙炔(CH)充分燃烧,所耗用氧气的量由多到少,故C错误;
D.乙醇为中性,苯酚显弱酸性,乙酸显酸性,且乙酸与苯酚钠反应生成苯酚,则CH3CH2OH、 、CH3COOH的酸性由弱到强,故D正确;
、CH3COOH的酸性由弱到强,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、盐类水解、非金属性与氢化物稳定性为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Cl--2e-=Cl2↑ | B. | Cu2++2e-=Cu | ||
| C. | 4OH--4e-=2H2O+O2↑ | D. | 2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 蛋白质可以通过烧焦时的特殊气味进行鉴别 | |
| C. | 乙烯和聚乙烯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com