
A、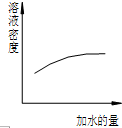 氨水的稀释 |
B、 等质量锌粉与足量盐酸反应 |
C、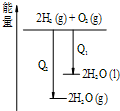 氢气与氧气反应 中的能量变化 |
D、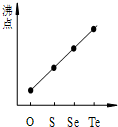 气态氢化物沸点 |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、把a L 0.1mol/L的CH3COOH溶液与b L 0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 |
| C、把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+) |
| D、常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③⑤ |
| C、①②④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2mol NO和1mol O2混合后,体系中的原子总数大于6NA |
| B、0.01mol Mg在CO2中完全燃烧,转移电子数为0.02NA |
| C、标准状况下,3.2g Cu与足量的浓硝酸反应生成气体的分子数为0.2NA |
| D、7.8g Na2O2含有的阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
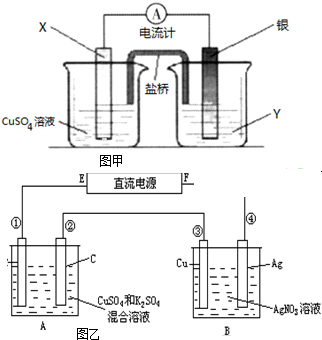
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com