
| A. | 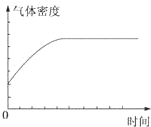 | B. | 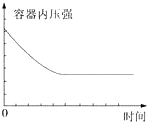 | ||
| C. | 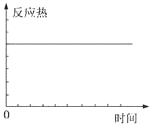 | D. | 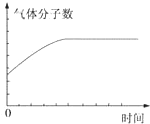 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、如果W是非气态,则密度开始减小,而不是增大;如果W是气体气体密度始终不变,所以不能作平衡状态的标志,故A错误;
B、不论W是何状态,开始容器内的压强是增大,而不是减少,故B错误;
C、反应热始终是一个定值,不能作平衡状态的标志,故C错误;
D、不论W是何状态,反应开始物质的量增加,分子数增多,一旦分子数不变说明达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol 羟基(-OH)含有的电子数为10 NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成H2的分子数为0.3 NA | |
| C. | 7.8 g Na2S、Na2O2的固体混合物中含有的阴离子数为0.1 NA | |
| D. | 用惰性电极电解饱和食盐水,电路中通过NA个电子,则阳极产生气体11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 大理石投入稀硝酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 氨水与硫酸铝溶液混合:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| D. | 氯水通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A | 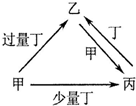 | NaOH | NaHCO3 | Na2CO3 | CO2 |
| B | C | CO | CO2 | O2 | |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
| D | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ③>④>②>① | D. | ①=②=③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在反应中仅体现还原性 | |
| B. | 被氧化和被还原的物质的物质的量之比为1:1 | |
| C. | 每生成0.1molClO2转移0.2mol电子 | |
| D. | 氧化性:NaClO3<Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com