
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | 现象:溶液变成黄色。 结论: 。 |
| 步骤2:__________________________ __________________________________ | 现象: ; 结论: |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
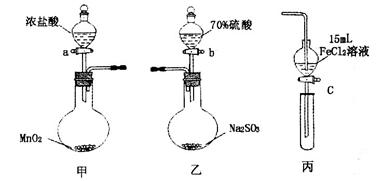
| | 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 |
| I | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B.在反应过程中,溶液的pH基本不变 |
| C.在反应过程中,Fe2+和Fe3+的总量保持不变 |
| D.H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②⑥ | C.①③④⑤⑥ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl2>HI>H2SO3>NO | B.H2SO3>HI>FeCl2>NO |
| C.I2>FeCl2>H2SO3>NO | D.NO>FeCl2>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.NO2、Na、Br2 | D.O2、SO2、H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com