
| A. | 63.8 g | B. | 53.6 g | C. | 46.8 g | D. | 43.2 g |
分析 Mg、Cu在反应中失去电子,最终生成Mg(OH)2、Cu(OH)2,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,根据生成NO的气体的物质的量,可知反应中转移电子的物质的量,结合氧化还原反应得失电子数目相等,可知最终生成沉淀的质量.
解答 解:反应中Cu$\stackrel{-2{e}^{-}}{→}$Cu2+$\stackrel{2O{H}^{-}}{→}$Cu(OH)2,Mg$\stackrel{-2{e}^{-}}{→}$Mg2+$\stackrel{2O{H}^{-}}{→}$Mg(OH)2,可知Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,
根据反应:4NO+3O2+2H2O=4HNO3,消耗6.72LO2转移的电子为$\frac{6.72L}{22.4L/mol}$×4=1.2mol,可知Mg、Cu在反应中失去电子的物质的量等于
消耗氧气得到电子的物质的量,即1.2mol,所以反应后生成沉淀的质量为26.4g+1.2mol×17g/mol=46.8g.
故选C.
点评 考查混合物的计算,难度中等,解题关键是判断沉淀质量为金属与金属离子结合氢氧根离子的质量之和,Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,注意电子守恒在解题中的应用.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、OH-、SO42- | B. | Fe3+、K+、Cl-、SCN- | ||
| C. | Na+、K+、CO32-、NO3- | D. | H+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
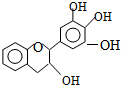 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )| A. | 分子中所有的原子不可能完全共面 | B. | 1molEGC与4molNaOH恰好完全反应 | ||
| C. | 易发生水解反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
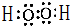
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
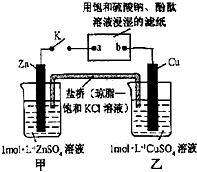
| A. | Cu电极上发生还原反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com