
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Cl2+H2O═H++Cl-+HClO | |
| D. | CO32-+2H+═CO2↑+H2O |
分析 A.该反应表示铁与可溶性铜盐的一类反应;
B.该反应可以表示氢氧化钡与硫酸、氢氧化钡与硫酸氢钠(过量)的反应;
C.该反应只能表示氯气与水的反应;
D.该反应表示可溶性碳酸盐与强酸反应生成可溶性盐和水的一类反应.
解答 解:A.Fe+Cu2+═Fe2++Cu中铜离子对应的盐可以为氯化铜、硫酸铜、硝酸铜等,所以该反应表示多个化学反应,故A错误;
B.离子方程式Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O可能是氢氧化钡与硫酸的反应,也可以为氢氧化钡与过量的硫酸氢钠的反应,故B错误;
C.离子方程式Cl2+H2O═H++Cl-+HClO只能表示Cl2和H2O反应生成氯化氢和次氯酸,满足条件,故C正确;
D.CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成可溶性盐和水的反应,如碳酸钠、碳酸钾等于硝酸、硫酸、盐酸等的反应,故D错误;
故选C.
点评 本题考查了离子方程式的书写方法,题目难度中等,明确离子方程式表示的意义为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 向Al(OH )3胶体中加入酒精溶液能发生聚沉现象 | |
| B. | 豆浆和雾都是胶体 | |
| C. | Fe(OH )3 胶体能透过滤纸 | |
| D. | 向沸水中加入饱和的FeCl3溶液,可制备Fe(OH )3 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
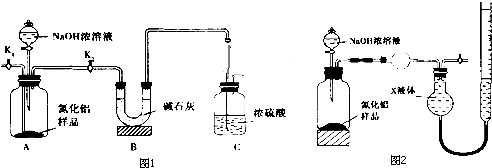

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
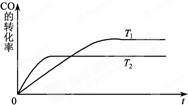 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).分析该反应并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=+763.3kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-763.3kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-675.3kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-1526.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 胶体与浊液的本质区别是其稳定性,胶体属于介稳体系 | |
| D. | 利用丁达尔效应可以区分溶液和胶体溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com