
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、 NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是 ( )
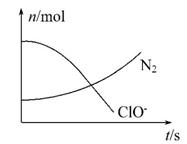
A.还原剂是NH3,氧化产物是Cl-
B.配平后氧化剂与还原剂的化学计量数之比为3∶2
C.该反应中氧化反应过程是ClO-→Cl-
D.标准状况下,若生成2.24 L N2,则转移电子为0.5 mol
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
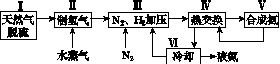
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
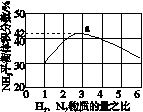

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原
反应的化学方程式:__________________、__________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一 定比例加入氨水或碳酸
氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原
因可能是______________;②析出的晶体可用于造纸工业,也可用于照相用
显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol·L-1 NaOH溶液反应,共用去10.00 mL碱液时恰好中和。下列说法中不正确的是( )
A.原混合液中c(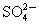 )=0.1 mol·L-1
)=0.1 mol·L-1
B.原混合液中c(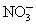 )=0.9 mol·L-1
)=0.9 mol·L-1
C.原混合液中pH=0
D.原混合液中由水电离出的c(H+)=10-14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl====2NaCl+H2O2
B.Ag2O+H2O2====2Ag+O2↑+H2O
C.2H2O2====2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH====2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同) ,H2O2既体现氧化性又体现还原性的反应是 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是 。
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、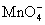 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为 mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O====A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列过程都能自发进行,其中不能用“焓判据”解释的是( )
|
| A. | 2Na(s)+Cl2(g)═2NaCl(s)△H<0 |
|
| B. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H<0 |
|
| C. | 2NH4Cl(s)+Ca(OH)2(s)═2NH3(g)+CaCl2(s)+2H2O(l)△H>0 |
|
| D. | 2Mg(s)+O2(g)═2MgO△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下面A~F是几种常见烃的分子球棍模型.

根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 .
(2)能够发生加成反应的气态烃是 .
(3)一氯代物的同分异构体最多的是 .
(4)所有原子均在同一平面上的是 .
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com