
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
图(1) 图(2)
图(2)
图(3)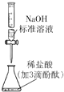 图(4)
图(4)
A. 图(1)用于除去CO2中的HCl气体
B. 图(2)表示已组装的铜锌原电池
C. 图(3)用于测定某稀盐酸的物质的量浓度
D. 用图(4)装置制备Fe(OH)2并能较长时间观察其颜色
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列不属于碳原子成键特点的是( )
A.易失去最外层的电子形成离子
B.最外层电子能与其他原子的外层电子形成共用电子对
C.能够形成单键、双键和三键
D.每个碳原子最多与其他原子形成4个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、CO32-,选用的方案是先取少量的滤液滴加过量的____,发现有气泡生成,再向其中加入_____溶液,出现白色沉淀,则可证明SO42-、CO32-均存在。
(2)如何检验MgCO3沉淀是否洗涤干净?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO34NO2↑+O2↑+2H2O)。

请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为________,产生该气体的化学方程式是____________。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为____________(填化学式)。
(3)装置B的作用是__________________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是________。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
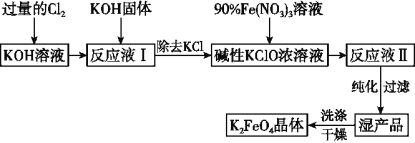
【题目】高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能处理剂,其生产工艺如图所示:
已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液
②在0~5 ℃、强碱性溶液中比较稳定
③在Fe3+和Fe(OH)3催化作用下发生分解
④在酸性至碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度___________的情况下进行(填“较高”或“较低”)。
(2)生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为______________。
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,则该反应的化学方程式为________________。
(4)在“反应液Ⅰ”中加KOH固体的目的是___________。
A. 为下一步反应提供反应物
B. 与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
C. KOH固体溶解时会放出较多的热量,有利于提高反应速率
D. 使副产物KClO3转化为KCl
(5)制备K2FeO4时,须将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌。采用这种混合方式的原因是_______________________ (答出1条即可)。
(6)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有________ (写化学式)。
(7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96 g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性)。以1.0 mol/L的硫代硫酸钠标准溶液为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00 mL,则原高铁酸钾样品中高铁酸钾的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应符合绿色化学概念的是
A. 制CuSO4:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B. 制CuSO4:2Cu+O2![]() 2CuO;CuO+H2SO4(稀)=CuSO4+H2O
2CuO;CuO+H2SO4(稀)=CuSO4+H2O
C. 制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
D. 制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
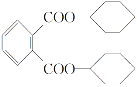
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | a: | 氯水中含有Cl- |
② | 将氯水滴加到含酚酞的NaOH溶液中 | 红色溶液 变为无色 | …… |
③ | 将氯水滴加到Na2CO3溶液中 | b: | 氯水中含有H+ |
(1)写出实验①和③的实验现象。
a:________________,b:________________。
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸,你是否同意这个观点?________(填“同意”或“不同意”),理由是________________________________________________。
(3)在分析实验②中实验现象产生的原因时,同学们的意见出现了分歧。甲同学认为氯水加到NaOH溶液中发生了中和反应而使溶液退色,乙同学认为氯水中含有的次氯酸具有漂白性而使溶液褪色。请你设计简单的实验证明他们的观点:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com