
常温条件下列溶液中离子浓度的等量关系正确的是( )
A.0.1mol/L氨水中:c(NH4+)+ c(H+) = c(OH-)
B.0.1mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-)
C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + 2c(NH3·H2O) = 2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)= c(H+)
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的框架
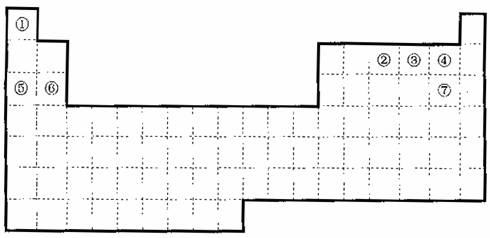
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示)。
B.周期中表的元素④和元素⑦的氢化物的熔、沸点高低顺序是
(用化学式表示)。
C.①―⑦元素的某单质有常温下化学性质稳定,通常可以保护气的是
(用化学式表示)。
D.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写离母a、b、c、d)。
a.IA族 b.ⅡA族 c.ⅣA族 d.VIIA族
 (3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,请写出此条件下表示①的单质燃烧的热化学方程式 ;
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,请写出此条件下表示①的单质燃烧的热化学方程式 ;
①、③两种元素的单质已被应用于宇宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
请回答:b是电池的 极;a电极上的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年重庆市沙坪坝区南开中学高三(上)月考化学试卷(12月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com