
| A. | ②③④⑤ | B. | ②④ | C. | ①②④⑤ | D. | ②③ |
分析 ①化学反应的原则是:酸性强的酸制弱酸弱的酸,一般情况不能由弱酸制强酸.碳酸的酸性强于硅酸、次氯酸,弱于盐酸;
②硅酸钠溶液通二氧化碳,生成硅酸和碳酸钠,硅酸是不溶于水的沉淀;
③饱和Na2CO3溶液通入足量的二氧化碳,生成碳酸氢钠,碳酸氢钠溶解度小于碳酸钠,沉淀析出;
④Ca(ClO)2溶液通入过量的二氧化碳生成可溶性的碳酸氢钙和次氯酸;
⑤澄清石灰石中通入足量的二氧化碳生成可溶性的碳酸氢钙可溶性溶液,不会产生沉淀.
解答 解:①CaCl2溶液与二氧化碳不反应,故①不符合;
②硅酸钠溶液通二氧化碳反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3硅酸是一种白色沉淀,故②符合;
③饱和Na2CO3溶液通入足量的二氧化碳,由Na2CO3+H2O+CO2=2NaHCO3可知,此反应消耗水,且Na2CO3转化为NaHCO3后溶质质量增加,又因NaHCO3溶解度较小,所以会有晶体析出,故③符合;
④Ca(ClO)2溶液通入二氧化碳发生反应:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO,无沉淀产生,故④不符合,
⑤澄清的石灰水通入过量的二氧化碳,2CO2+Ca(OH)2=Ca(HCO3)2,不会产生沉淀,故⑤不符合;
故选D.
点评 本题考查了碳的氧化物及其对应碳酸盐和碳酸氢盐的性质,题目难度不大,注意碳酸钠和碳酸氢钠溶解性的差别.


科目:高中化学 来源: 题型:填空题
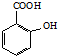 )反应能得到化学式为C7H5O3Na的是A
)反应能得到化学式为C7H5O3Na的是A查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝罐可久盛食醋 | |
| B. | 铝与Fe2O3发生铝热反应,反应后固体物质增重 | |
| C. | 氢氧化铝可作胃酸的中和剂 | |
| D. | 明矾用作净水剂不涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1NA个氢气分子所占的体积为22.4L | |
| B. | 2NA个二氧化碳分子的摩尔质量为88g/mol | |
| C. | 1000mL 0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可用于制胃酸中和剂 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 二氧化硫可广泛用于食品的漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作步骤 | 实验现象 | 结论 |
| Ⅰ取样; | 加入KSCN溶液溶液变红; | 溶液中存在Fe3+; |
| Ⅱ取样. | 加入酸性KMnO4溶液颜色褪去. | 溶液中存在Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液为浅绿色 | |
| B. | 溶液为棕黄色 | |
| C. | 加入硫氰化钾溶液显红色 | |
| D. | 滴加NaOH溶液,产生白色沉淀,该沉淀放置在空气中不变色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com