
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
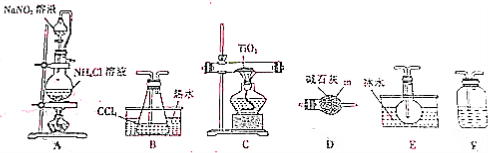
分析 (1)结合常见仪器的结构可确定仪器m的名称;
(2)制备氮气的反应其原理是NaNO2和NH4Cl中氮元素自身的归中氧化还原反应;
(3)(4)装置A产生的氮气含有水蒸气,通过装置F中浓硫酸除去,然后利用干燥的氮气将四氯化碳蒸气吹入C装置,使四氯化碳和二氧化钛反应,B装置目的是将四氯化碳液体转化为气体,C中发生反应TiO2(s)+CCl4(g)$\stackrel{△}{→}$TiCl4(g)+CO2(g),E中降低温度目的是得到液态TiCl4,装置D是一个干燥装置,防止外界的水汽进入TiCl4收集装置里;
(5)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶;
(6)终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;
(7)在上述实验装置中将通氮气改为通氯气,撤去装置B,石英管内二氧化钛要改为二氧化钛和C的混合物,因为氯气、CO有毒,需要有尾气处理装置和生成CO的吸收装置.
解答 解:(1)仪器m为球形干燥管,用于干燥气体,故答案为:球形干燥管;
(2)装置A中有氮气生成,是NaNO2和NH4Cl中氮元素自身的归中氧化还原反应,化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O;
故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O;
(3)装置A产生的氮气含有水蒸气,通过装置F中浓硫酸除去,然后利用干燥的氮气将四氯化碳蒸气吹入C装置,使四氯化碳和二氧化钛反应,B装置目的是将四氯化碳液体转化为气体,C中发生反应TiO2(s)+CCl4(g)$\stackrel{△}{→}$TiCl4(g)+CO2(g),E中降低温度目的是得到液态TiCl4,装置D是一个干燥装置,防止外界的水汽进入TiCl4收集装置里,实验装置依次连接的顺序为A→F→B→C→E→D;
故答案为:B;C;E;浓硫酸;
(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里;
故答案为:防止外界的水汽进入TiCl4收集装置里;
(5)D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,但CCl4和TiCl4是两种沸点差异较大的液体混合物,应该用蒸馏进行分离;
故答案为:蒸馏;
(6)终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;
故答案为:②③①;
(7)在上述实验装置中将通氮气改为通氯气,撤去装置B,石英管内二氧化钛要改为二氧化钛和C的混合物,因为氯气有毒,需要有尾气处理装置,可以通过碱石灰的干燥管吸收;增加CO的吸收装置(答橡胶袋、盛醋酸亚铜氨的洗气瓶等均可).
故答案为:石英管内改为盛TiO2和C;增加CO的吸收装置;
点评 本题考查物质制备,侧重考查学生实验操作、物质分离和提纯、盐类水解等知识点,明确实验原理及实验基本操作方法、知道各个装置作用是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | s轨道与s轨道之间可以在任何方向上成键,所以共价键都没有方向性 | |
| D. | s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO3溶液,浓H2SO4 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 过量的饱和碳酸钠溶液 | 分液 |
| C | Na2CO3(s) | NaHCO3(s) | 无需添加 | 灼烧 |
| D | 甲烷 | 乙烯 | 酸性KMnO4,浓H2SO4 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
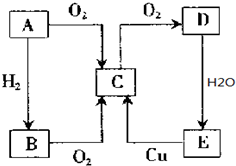 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2SO4 | B. | NaOH、CuSO4 | C. | HCl、CuCl2 | D. | NaCl、AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com