
| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
分析 X形成的简单阳离子核外无电子,应为H元素,Z是人体内含量最多的元素,应为O元素,Y的最高价氧化物对应的水化物是强酸,应为N元素,T在同周期元素形成的简单阳离子中半径最小,依据同周期金属离子半径小于非金属离子半径,且同周期金属离子核电荷数越大离子半径越小可知应为Al元素,以此解答该题.
解答 解:X形成的简单阳离子核外无电子,应为H元素,Z是人体内含量最多的元素,应为O元素,Y的最高价氧化物对应的水化物是强酸,应为N元素,T在同周期元素形成的简单阳离子中半径最小,依据同周期金属离子半径小于非金属离子半径,且同周期金属离子核电荷数越大离子半径越小可知应为Al元素,
A.Z为O元素,元素最高化合价为0,应为N>Al>H>O,故A错误;
B.非金属性O>N,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.由X、Y和Z三种元素构成的强电解质可为硝酸铵,为强酸弱碱盐,水解可促进水的电离,故C错误;
D.常温下,铝与浓硝酸发生钝化反应,故D错误.
故选B.
点评 本题考查元素的结构与元素的性质,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意正确推断元素的种类为解答该题的关键,易错点为D.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
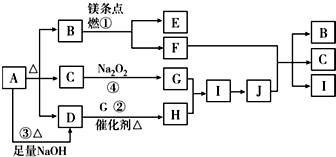
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
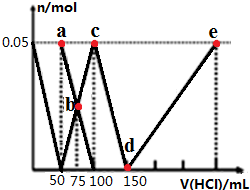
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
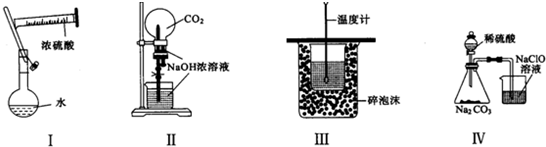
| A. | 实验Ⅰ:配制一定物质的量浓度的稀硫酸 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:验证酸性的强弱,H2SO4>H2CO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
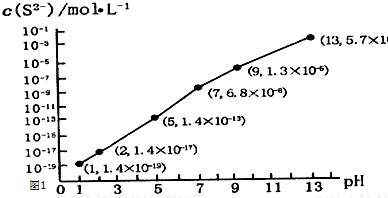
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com