
| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
分析 反应2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,则体积缩小时压强增大,C的浓度大于2xmol/L,即增大压强,化学平衡正向移动,以此来解答.
解答 解:反应2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,则体积缩小时压强增大,C的浓度大于2xmol/L,即增大压强,化学平衡正向移动,
A.增大压强,化学平衡向气体体积缩小的方向移动,所以b>c,故A错误;
B.容器的容积减小后,反应物的浓度增大,压强增大,所以该反应的逆反应速率增大,故B错误;
C.1min时达到平衡,C的浓度为x mol•L-1,v(C)=xmol•L-1•min-1,由反应速率之比等于化学计量数之比可知,v(B)=$\frac{bx}{c}$mol•L-1•min-1,故C错误;
D.若保持温度和容器的容积不变,充入氦气(不参与反应),反应体系中各物质的浓度不变,平衡不移动,故D正确;
故选C.
点评 本题考查化学平衡的计算,明确体积缩小时C的浓度变化来判断平衡移动的方向是解答本题的关键,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 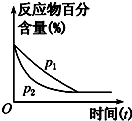 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时可以精铜为阳极,以CuSO4溶液为电解液 | |
| B. | 电解时阴极发生还原反应 | |
| C. | 粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+ | |
| D. | 电解结束后,电解质溶液的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com