
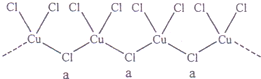
已知铜氨溶液中存在如下平衡:[Cu(NH3)]42+![]() Cu2++4NH3.
Cu2++4NH3.
某一混合液含有Ag+、Fe3+和Al3+,可以下列流程图加以分离和鉴定.

(1)写出滤液A中主要的阳离子的化学式________.
(2)解释步骤②中生成沉淀B的原因________.
(3)写出步骤③中发生反应的离子方程式________.
(4)溶液G中的金属离子的鉴定方法________.
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013届福建省三明一中、二中高三上学期期末联考化学试卷(带解析) 题型:填空题
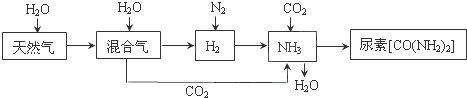
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。
(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染。
已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)=2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的_____倍(计算结果保留1位小数)。
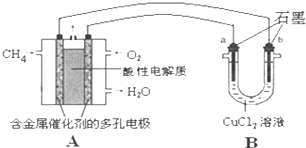
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: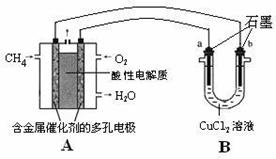
请回答:
①甲烷燃料电池的正极反应式是____ ____。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(4)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省、二中高三上学期期末联考化学试卷(解析版) 题型:填空题
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。

(1)天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)甲烷是一种清洁燃料,但不完全燃烧时热效率降低,同时产生有毒气体造成污染。
已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g)=2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的_____倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的正极反应式是____ ____。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(4)运输氨时,不能使用铜及其合金制造的管道阀门。因为在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成[Cu(NH3)4]2+,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
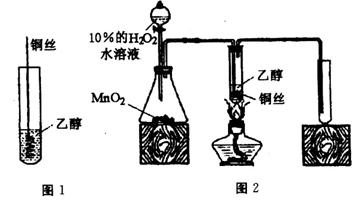
方法1:如图1,把一段弯成螺旋状的铜丝在酒精灯外焰中加热,变黑后立即伸入乙醇中,反复3次,闻到了乙醛的刺激性气味,取试管内液体,分别与银氨溶液和新制的Cu(OH)2反应,却未看到明显的现象。
方法2:如图2,弯成螺旋状的铜丝浸入5 mL无水乙醇中,加热一段时间后,在右侧试管中收集到2 mL液体,未闻到乙醛的刺激性气味,取所得液体,分别与银氨溶液和新制的Cu(OH)2反应,也未看到明显的现象。
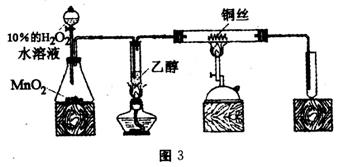
方法3:如图3,螺旋状的铜丝放在横置的硬质玻璃管中,试管内加5 mL无水乙醇,加热一段时间后,在右侧试管中也收集到2 mL液体,并闻到了乙醛的刺激性气味。取所得液体分别与银氨溶液和新制的Cu(OH)2反应,看到了银镜和红色沉淀。
请回答下列问题:
(1)若银氨溶液和新制Cu(OH)2等试剂和实验操作都正确无误,则方法1中未看到银镜和红色沉淀的原因可能是___________;
(2)方法2中,最左侧装置内发生反应的化学方程式为________________________________;
这一装置的作用是______________________________________________________________;
方法2实验中根本没有乙醛生成,原因是__________________________________________。
(3)方法3中,产生银镜或红色沉淀的化学方程式是(任选写出一个):____________________。
在收集到的液体中,除乙醛和乙醇外,还含有的物质是_______________________;
请设计一个简单的实验,证明该液体中乙醇的存在,简要写出操作步骤、所用试剂、现象和结论:_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com