
【题目】已知![]() ,
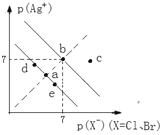
,![]() 。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A. ![]()
![]()
B.向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
C.一定温度下,AgCl固体分别在下列溶液a.![]() 、溶液b.
、溶液b.![]() 蒸馏水、c.
蒸馏水、c.![]() 溶液中的溶解度由大到小的排列顺序是b>a>c
溶液中的溶解度由大到小的排列顺序是b>a>c
D.常温下,AgCl在纯水中的![]() 比在
比在![]() 溶液中的
溶液中的![]() 大
大
科目:高中化学 来源: 题型:
【题目】煤的综合利用有如下转化关系。CO和H2按不同比例可分别合成A和B,已知烃A对氢气的相对密度是14,B能发生银镜反应,C为常见的酸味剂。
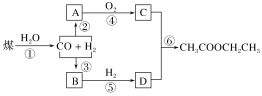
请回答:
(1)有机物D中含有的官能团的名称为______________。
(2)反应⑥的类型是______________。
(3)反应④的方程式是_______________________________________。
(4)下列说法正确的是________。
A.有机物A能使溴水和酸性高锰酸钾溶液褪色
B.有机物B和D能用新制碱性氢氧化铜悬浊液鉴别
C.有机物C、D在浓H2SO4作用下制取CH3COOCH2CH3,该反应中浓H2SO4是催化剂和氧化剂
D.有机物C没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
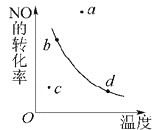
A.a点B.b点C.c点D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:

①A只有一种一氯取代物B。写出由A转化为B的化学方程式 ;
②A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是 。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与氯化铁溶液发生显色反应。“HQ”还能发生的反应是 (选填序号);
①加成反应②氧化反应③加聚反应④水解反应
若“HQ”的一硝基取代物只有一种,则“HQ”的结构简式为 。
(3)A与“HQ”在一定条件下相互作用生成水和一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液反应得到化学式为C10H12O2Na2的化合物,则“TBHQ”的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是

A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看图回答下列问题。

(1)钢铁的电化学腐蚀原理如图所示:
①该电化学腐蚀称为_____反应的负极反应式:____________
②为了利用电解池原理保护铁电极,要在如图的虚线方框内加上直流电源,铁应与电源的_____(填负或正)极相连,并写出石墨电极的电极反应式________________
③把如图中NaCl溶液用盐酸代替,则石墨电极产生的现象_________
(2)利用电镀原理在铁件表面镀铜。装置如图所示:
①电镀时镀件作______(填阳或阴)极
②A电极的电极反应式是_______
③若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量, 二者质量差为1.28 g,则电镀时电路中通过的电子为_____________mol。
(3)如图所示进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是________
a.阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
b.粗铜接A极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Au金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH4+和[Cu(NH3)4]2+中都存在配位键
B.  σ键和π键比例为7:1
σ键和π键比例为7:1
C. ![]() 与
与![]() 互为等电子体,1 mol
互为等电子体,1 mol ![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com