
����Ŀ���������ʽṹͼ�У������ԭ��������1��10��Ԫ�ص�ԭ��ʵ��ԭ��ʵ��ԭ�ӳ�ȥ�������Ӻ�ʣ��IJ��֣���С�ڵ�������γɹ��ۼ���������������ӣ����ߴ������ۼ�����F2�� ![]() ��
�� 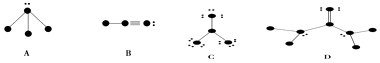
��1����д������ͼʾ�������Ļ�ѧʽ��A �� B �� C �� D ��
��2���������������ʵ�Һ���ϸ�����£��ô�����IJ���������ϸ����ϸ������ƫת�������A����B����C����D������
��3��B�����������ļ������м���
��4��C�����У�����ԭ���ӻ���������ӿռ乹���� ��
���𰸡�
��1��CH4��HCN��BF3��CO��NH2��2
��2��B
��3��2��2
��4��sp2z��ƽ��������
���������⣺��1��A����A�������м�ԭ���γ�4�����ۼ���û�е���ʣ�࣬�����������4�����ӣ���1��10��Ԫ����ֻ��C������4��ԭ�Ӹ�ֻ�γ�һ�����ۼ���û�е���ʣ�࣬�������ֻ��1�����ӣ���ΪHԪ�أ�����A�Ļ�ѧʽΪCH4�� B����B�������м�ԭ���γ�1��������1��������û�е���ʣ�࣬�������ֻ��4�����ӣ�ΪCԪ�أ��ұߵ�ԭ���γ�1��������ʣ�����Ϊ2�������������5�����ӣ���1��10��Ԫ����ֻ��N�����ԭ���γ�1��������ûʣ����ӣ�ΪH����B�Ļ�ѧʽΪHCN��
C���м�ԭ���γ�3�����ۼ���û�е���ʣ�࣬�����������3�����ӣ���1��10��Ԫ����ֻ��BԪ�أ�����ԭ���γ�1�����ۼ�����ʣ��3�Ե��ӣ���ԭ������������Ϊ7����ΪFԪ�أ�����D�Ļ�ѧʽBF3��
D���м�ԭ���γ�4�����ۼ���û�е���ʣ�࣬�����������4�����ӣ���1��10��Ԫ����ֻ��C��ֻ��Cԭ���γ�2�����ۼ�������4��ʣ����ӣ���ԭ��ΪOԪ�أ���Cԭ���γ�1�����ۼ�����������ԭ�����γ�2�����ۼ�����ʣ��1�Ե��ӣ���ԭ������������Ϊ5����ΪNԪ�أ���Nԭ�����ڵ�ԭ��ֻ�γ�һ�����ۼ���û�е���ʣ�࣬�������ֻ��1�����ӣ���ΪHԪ�أ�����C�Ļ�ѧʽCO��NH2��2��
���Դ��ǣ�CH4��HCN��BF3��CO��NH2��2����2�����Է����ھ��������»ᷢ��ƫת�����ڼ��Է��ӵ���HCN��
���Դ��ǣ�B����3��HCN�к���һ��������һ�����������������2���ļ���2���м���
���Դ��ǣ�2��2����4��BF3�����У�����ԭ��B�ļ۲���Ӷ���Ϊ3+ ![]() ��3+3��1��=3���ӻ�����Ϊsp2 �� Bԭ��û�йµ��Ӷԣ�����ӿռ乹����ƽ�������Σ�
��3+3��1��=3���ӻ�����Ϊsp2 �� Bԭ��û�йµ��Ӷԣ�����ӿռ乹����ƽ�������Σ�
���Դ��ǣ�sp2��ƽ�������Σ�


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������Ϊ���������Ϳ�ű���������أ����2015��ŵ�������������ؿ�����éȩΪԭ����ȡ������˵��������ǣ� �� 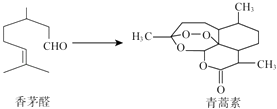
A.��éȩ��ʹBr2��CCl4��Һ��ɫ
B.�����ط���ʽΪC15H22O5
C.�����غ��к�H2O2��ͬ�Ĺ�����
D.�������������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.2mol NaOH��0.1mol Ca��OH��2����Һ�г����ȶ���ͨ��CO2���壬��ͨ������Ϊ6.72L��S��T��P��ʱ����ֹͣ������һ�����У���Һ�����ӵ����ʵ�����ͨ��CO2����������ϵ��ȷ��ͼ���ǣ�������ܽ���Բ��ƣ��� ��
A.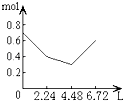
B.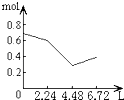
C.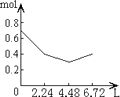
D.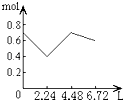
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�����ƹ����л�����Ũ��ƫ�ߵ��ǣ� ��
A.��1g98%��Ũ�����4gˮ���Ƴ�19.6%������
B.����һ�����ʵ���Ũ�ȵ�������Һʱ�����ݺ��������ӵ�תҡ�Ⱥ���Һ����ڿ̶���
C.10%�������90%�����������������50%��������Һ
D.��������Ϊ5x%��x%�����ְ�ˮ�����������Ƴ�3x%�İ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4��H2��C�������ʵ���Դ���ʣ�����ȼ�յ��Ȼ�ѧ����ʽΪ�� ��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=��890.3kJ/mol
��2H2��g��+O2��g���T2H2O��l����H=��571.6kJ/mol
��C��s��+O2��g���TCO2��g����H=��393.5kJ/mol
��1����д���һ�ּ���ϸ������������øʹ������O2���ò���������������ϸ��ʹ1mol��������CO2������Һ̬ˮ���ų����������������������=����890.3kJ��
��2��������CO2�����ںϳɺϳ�������Ҫ�ɷ���һ����̼����������CH4+CO2�T2CO+2H2 �� 1gCH4��ȫ��Ӧ���ͷ�15.46kJ���������� ��ͼ1���ܱ�ʾ�÷�Ӧ�����������仯����������ĸ����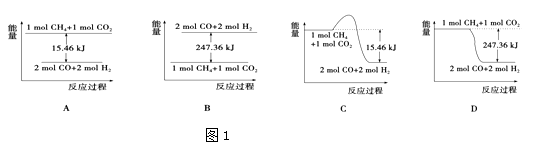
���������ʵ�����Ϊ1mol��CH4��CO2����ij�����ܱ������У���ϵ�ų�����������ʱ��ı仯��ͼ2��ʾ����CH4��ת����ԼΪ �� 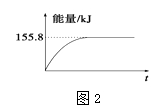
��3��C��s����H2��g������Ӧ������C��s��+2H2��g���TCH4��g���ķ�Ӧ����ֱ�Ӳ�������ͨ��������Ӧ�����C��s��+2H2��g���TCH4��g���ķ�Ӧ�ȡ�H= ��
��4��ͼ3�Ǽ���ȼ�ϵ��ԭ��ʾ��ͼ����ش��������⣺ 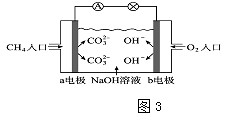
�ٵ�صĸ��������a����b�����缫�������ϵĵ缫��Ӧ�� ��
�ڵ�ع���һ��ʱ���������Һ��pH���������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X���ȷֽ⣬�ɵ�A��B��D��E��F��ˮ���ֲ������A��B��D������ѧ��ѧ�г������������E�ǵ���F����Ԫ�ص��⻯�
��1��A������ǿ�ᡢǿ�д��A��ǿ����Һ��Ӧ�����ӷ���ʽ��
��2��B��D������������������Ԫ����ͬ��D����ˮ��ǿ�ᣮ��B��D�����г�����������һ��Ԫ�������ڱ��е�λ��Ϊ ��
��3��E��ʹʪ��ĺ�ɫʯ����ֽ������ʵ������ȡE����Ļ�ѧ����ʽΪ �� �Ƶõ����������ͼ��ʾװ���ռ���������Ӧ�����A����B����ͨ�룮 
��4���ɸ��ֽ��������ʵ���֮���Ʋ�X���������������������X��Ũ��Һ�еμ�NaOH��Һ����������������Ϊ �� �� ��
��5��ȡһ������X����ֽ⣬������F 1mol�����ͬʱ�������ʣ��ѧʽ��mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1��ͬ���칹�������л���������������Ҫԭ����ȷʶ����ж�ͬ���칹����ѧϰ�л���ѧ����Ҫ������ �����з���ʽ��ʾ����������ͬ���칹����� ��
A��CH4O B��C2H4 C��C2H5Cl D��C2H4O2
�����ú˴Ź��������жϳ�����ʽΪC2H6O���л���������ͬ���칹�壬�ں˴Ź�����������һ����������л���Ľṹ��ʽ�� ��
����֪C4H9Cl�������ֽṹ�������ʽΪC5H10O��ȩ����ͬ���칹�壮
��2�����ȼ��2.8gij�л���A������8.8g CO2��3.6g H2O�������л�������������ܶ�����ͬ������N2��2�������л���ķ���ʽΪ �� �����л���û�м�������ṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)����֤���Ƶ�Ӳ��С��ʵ����ʵ��_______________________________��
(2)����˵����Ȼ���в���������̬���Ƶ�ʵ����ʵ��______________��
(3)����֤���������۵�ߵ�ʵ����ʵ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�Ħ������������ (����)
A. 10 mL H2O B. 0.8 mol H2SO4
C. 54 g Al D. 1 g CaCO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com