

| A. | 用图a所示装置干燥NH3气体 | |
| B. | 用图b所示装置蒸发NaCl溶液得NaCl晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氯气的体积 |
分析 A.干燥气体,大口进,小口出,且氯化钙与氨气反应;
B.图为蒸发结晶操作;
C.水在上层,分液时避免上下层液体混合;
D.氯气溶于水.
解答 解:A.干燥管应该大口进气小口出气,且无水氯化钙不能干燥NH3,故A错误;
B.图为蒸发结晶操作,并利用玻璃棒不断搅拌,操作合理,故B正确;
C.水在上层,分液时避免上下层液体混合,则水层从分液漏斗上口倒出,故C错误;
D.氯气溶于水,不能将水排出测定其体积,应用排饱和食盐水的方法,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的干燥、蒸发、分液及气体体积测定等,把握物质的性质及实验基本操作为解答的关键,侧重实验技能的考查,注意操作的可行性、评价性分析,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫牺牲阳极的阴极保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
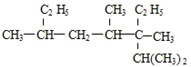 2,3,4,6-四甲基-3-乙基辛烷
2,3,4,6-四甲基-3-乙基辛烷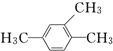 1,2,4-三甲苯
1,2,4-三甲苯查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
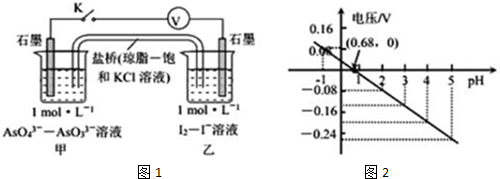
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
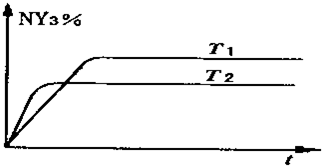
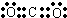 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
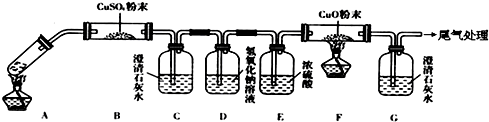
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com