
| A. | ①②⑥ | B. | ③④⑤ | C. | ③⑤⑦ | D. | ⑥⑦⑧ |
分析 ①明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2;
②HF为弱酸,应保留化学式;
③向澄清石灰水中加入少量小苏打溶液反应生成碳酸钙沉淀;
④电荷不守恒;
⑤钠与水反应生成氢氧化钠和氢气;
⑥碳酸钙为沉淀,应保留化学式;
⑦三价铁离子水解生成氢氧化铁胶体和氢离子;
⑧n(Fe2+):n(I-)=1:2.
解答 解:①明矾溶液中n(Al3+):n(SO42-)=1:2,设硫酸铝为1mol,应加入1.5molBa(OH)2,离子方程式应为2Al3++3SO42-+6OH-+3Ba2+═3BaSO4↓+2Al (OH)3↓,故①错误;
②氟气和水反应:2F2+2H2O=4HF-+O2,故②错误;
③向澄清石灰水中加入少量小苏打溶液反应生成碳酸钙沉淀,反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故③正确;
④铜片投入稀HNO3溶液,离子方程式应为3Cu+2NO3-+8H+═2NO↑+4H2O+3Cu2+,故④错误;
⑤钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故⑤正确;
⑥碳酸钙放入盐酸中:CaCO3+2H+=CO2↑+H2O+Ca2+,故⑥错误;
⑦向沸水中滴加FeCl3溶液制备Fe(OH)3胶体,离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故⑦正确;
⑧n(Fe2+):n(I-)=1:2,应为2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl-,故⑧错误;
故选:C.
点评 本题考查离子方程式的书写,侧重于元素化合物的性质的综合应用,明确反应实质是解题关键,注意物质的化学式、电荷守恒和质量守恒的判断,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
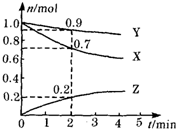 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )
某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为( )| A. | X+3Y=2Z 0.1mol•min-1 | B. | 2X+Y?2Z 0.1mol•min-1 | ||
| C. | X+2Y=Z 0.05mol•min-1 | D. | 3X+Y?2Z 0.05mol•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCO3难溶于水中,可用作X射线透视肠胃的内服药 | |
| B. | 中国在建的第二艘航母中使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 | |
| D. | 获得2015年诺贝尔医学奖的屠呦呦用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | |
| B. | 熔点:Al>K>Na | |
| C. | 碱性:Al(OH)3>Mg(OH)2>LiOH | |
| D. | 结合质子能力:CO32->CH3COO->SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2的质量是32g•mol-1 | |
| B. | SO 42-的摩尔质量为 96 g•mol-1 | |
| C. | 1mol 任何物质的质量等于该物质的相对分子质量 | |
| D. | CO2的摩尔质量是44g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| D | E |
| A. | A与B形成的阴离子可能有AB32-、A2B42- | |
| B. | AD2分子中每个原子的最外层均为8电子结构 | |
| C. | C和E氢化物的热稳定性和还原性均依次减弱 | |
| D. | A、D、E的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com