
 某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.
某研究性学习小组设计实验方案(见图)研究稀硝酸与铜反应生成NO.| 3V |
| 4 |
| 3V |
| 4 |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、红棕色NO2加压后颜色先变深后变浅 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 |
| D、压缩H2与I2(g)反应的平衡混合气体,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
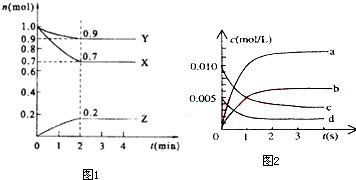
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:查看答案和解析>>
科目:高中化学 来源: 题型:
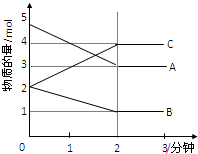 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
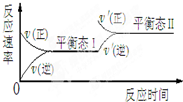 随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.
随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.| 物 质 | CO2 | H2 | CH3OH(g) | H2O(g) |
| 起始浓度(mol/L) | 1.0 | 3.0 | 0 | 0 |
| 10min末浓度(mol/L) | 0.75 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
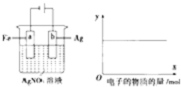 按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )| A、①③ | B、③④ |
| C、①②④ | D、①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com