
 ����ռ������Ҫ�Ļ���ԭ�ϣ�
����ռ������Ҫ�Ļ���ԭ�ϣ�| ʵ����� | ʵ������ | ���� |
| ��ȡ������ɫ�������Թ��У�������ˮ�ܽ⣬�ټ�����BaCl2��Һ | ������ɫ���� | ��CO32- |
| �ڹ��ˣ�ȡ2mL��Һ���Թ��� | ||
| �۵μӷ�̪ | ��Һ��� | ��OH- |
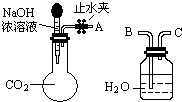
���� ��1��CO2��NaOH��Ӧ����Na2CO3����ƿ��ѹǿ��С�����жϳ��ֵ�����
��2���ȸ�����ԭ���غ㣬ͨ����ֵ��ȷ����ɫ�������ɣ��������������Լ���Ҫ��������������ҺBaCl2�����̼���ƣ�����̼�������ȫ����������ͨ���������ڵ�pH��ȷ���Ƿ���NaOH��
��3�������������̼���������Ƶ����ʵ��������ݷ�Ӧ��2NaOH+CO2=Na2CO3+H2O��Na2CO3+CO2+H2O=2NaHCO3������������̼���ơ�̼�����Ƶ����ʵ�����Ȼ��д����Ӧ�����ӷ���ʽ��
��� �⣺��1����A��B���ӣ���ֹˮ�У�����ͷ�ι��е�Һ�強����ƿ��������̼���ռ���Һ�����˷�Ӧ������ѹǿ��С������ˮ�ص����ɹ��ƿ������ƿ����Ӧ�����ӷ���ʽΪ2OH-+CO2=CO32-+H2O����OH-+CO2=HCO3-�����������������䣬����A��C���ӣ�������������뼯��ƿ���ɹ۲쵽�������ǹ��ƿ�еij����ܿ������ݲ�����
�ʴ�Ϊ��ˮ�ص����ɹ��ƿ������ƿ����ˮ����������ƿ����2OH-+CO2=CO32-+H2O����CO2+OH-=HCO3-�������ƿ�еij����ܿ������ݲ�����
��2��100mL 2mol/L��NaOH��Һ��ͨ��һ����CO2���ᾧ���õ�9.3g��ɫ���壬�������Ƶ����ʵ���Ϊ��2mol/L��0.1L=0.2mol���������ȫ��Ϊ̼���ƣ���̼���Ƶ�����Ϊ��106g/mol��0.2mol��$\frac{1}{2}$=10.6g����ȫ��Ϊ̼�����ƣ���̼�����Ƶ�����Ϊ��84g/mol��0.2mol=16.8g��˵���������ƹ�������ɫ����ΪNaOH��̼�����ƵĻ����������Ȼ��������Ȼ��ƣ���Һ����̼���ƵĴ��ڣ�����ɫ��̪�����������ƵĴ��ڣ�����Ϊ����ȡ������ɫ�������Թ��У�������ˮ�ܽ⣬�ټ�����BaCl2��Һ��������ɫ������˵����Һ�к���̼������ӣ��ڹ��ˣ�ȡ2mL��Һ���Թ��У��۵μӷ�̪����Һ��죬��˵����Һ�к���OH-��
�ʴ�Ϊ��NaOH��Na2CO3��
| ʵ����� | ʵ������ | ���� |
| ��ȡ������ɫ�������Թ��У�������ˮ�ܽ⣬�ټ�����BaCl2��Һ | ������ɫ���� | ��CO32- |
| �ڹ��ˣ�ȡ2mL��Һ���Թ��� | ||
| �۵μӷ�̪ | ��Һ��� | ��OH- |
���� ���⿼��ʵ��װ�õ��ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ����⿼���Ϊ�ۺϣ������ʵ��Ʊ�ʵ��Ϊ���壬�ۺϿ���ʵ�����ơ����ӷ���ʽ��д��֪ʶ��ע��������ʵ��������ʵ�鷽����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢۢ� | C�� | �٢ڢܢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
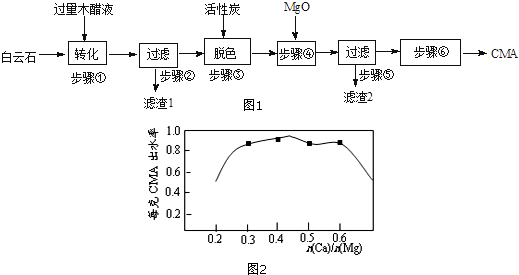
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
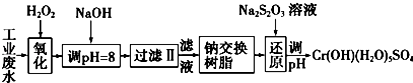
| �������� | Fe��OH��3 | Fe��OH��2 | Mg��OH��2 | Al��OH��3 | Cr��OH��3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O��Na2O2������������ | B�� | H2SO4��CH3COOH�������� | ||
| C�� | �ռ������ڼ� | D�� | Na2CO3��NaHCO3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
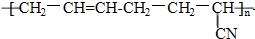 �������������͡��������ܣ���ϳɶ����ĵ�������ͻ�ѧ��Ӧ�������ͷֱ��ǣ�������
�������������͡��������ܣ���ϳɶ����ĵ�������ͻ�ѧ��Ӧ�������ͷֱ��ǣ�������| A�� | 1�� �Ӿ۷�Ӧ | B�� | 2�� ���۷�Ӧ | C�� | 2�� �Ӿ۷�Ӧ | D�� | 3�� ���۷�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ҺAG=0 | |
| B�� | ������0.1mol/L����������Һ��AG=12 | |
| C�� | ������ҺAG��0 | |
| D�� | ������0.1mol/L��������Һ��AG=13 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1mol�������е�ԭ����ΪNA | |
| B�� | ���³�ѹ�£�8g�����к��еĵ�����Ϊ5NA | |
| C�� | 22 g CO2 ���״����11.2 L O2������ͬ������ | |
| D�� | ��״���£�11.2L���Ȼ�̼���������� 0.5NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com