
 Na2CO3+H2O+CO2↑,生成水、二氧化碳,导致质量减轻,根据差量法计算混合物中碳酸氢钠的物质的量,生成的碳酸钠的物质的量.根据n=
Na2CO3+H2O+CO2↑,生成水、二氧化碳,导致质量减轻,根据差量法计算混合物中碳酸氢钠的物质的量,生成的碳酸钠的物质的量.根据n=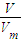 二氧化碳的物质的量,根据碳原子守恒计算加热后碳酸钠的物质的量,进而计算原混合物中碳酸钠的物质的量,据此计算解答.
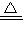
二氧化碳的物质的量,根据碳原子守恒计算加热后碳酸钠的物质的量,进而计算原混合物中碳酸钠的物质的量,据此计算解答. Na2CO3+CO2↑+H2O↑ 固体质量减少
Na2CO3+CO2↑+H2O↑ 固体质量减少  =0.08mol,
=0.08mol,

 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、2:3 | C、3:4 | D、4:5 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省扬州中学高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com