
| A. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
分析 A.发生银镜反应生成碳酸铵、银、氨气和水;
B.苯与溴水不反应,苯与液溴反应;
C.-Br、-COOH均与NaOH反应;
D.可能混有新杂质氢气.
解答 解:A.醛溶液与足量的银氨溶液共热的离子反应为HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故A正确;
B.苯能与液溴发生取代反应,但与溴水不反应,则能用苯萃取溴水中的溴,故B错误;
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热的离子反应为CH2BrCOOH+2OH-$\stackrel{△}{→}$CH2OHCOO-+Br-+H2O,故C错误;
D.不能通入氢气除杂,则除去乙烷中混有的乙烯的方法是通入溴水中洗气,故D错误;
故选A.
点评 本题考查较综合,涉及离子反应方程式书写的正误判断、混合物分离提纯、有机物的结构与性质等,注重高频考点的考查,把握发生的反应及离子反应的书写方法、有机物的性质等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,反应原理为:NaBr+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$HBr+NaHSO4,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.实验结束发现试管a中的物质分为三层.对该实验的分析不正确的是( )| A. | 产物在a中第一层 | |
| B. | a中有产物和水,还含HBr、Br2、CH3CH2OH等 | |
| C. | 反应过程中浓硫酸显示酸性、强氧化性、脱水性、难挥发性等性质 | |
| D. | 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红外光谱法鉴别乙醇和二甲醚 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷和乙炔 | |
| C. | 用碘水鉴别苯和四氯化碳 | |
| D. | 用溴的四氯化碳鉴别乙烯和乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;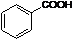 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
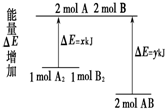
| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
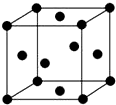 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
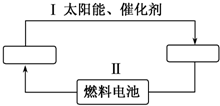 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com