
【题目】在含有大量Fe2+、H+、SO42-的溶液中,还可能大量共存的离子是
A. SCN—B. NO3-C. HCO3-D. Ba2+
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( ) 
A.简单离子的半径:X<Z<M
B.Y,R两种元素的气态氢化物稳定性:Y>R
C.最高价氧化物对应水化物的酸性:R<N
D.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.加热才能发生的反应一定是吸热反应
B.化学反应的热效应的大小与参加反应的物质的多少无关
C.反应物的总能量大于生成物的总能量的反应一定是放热反应
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:
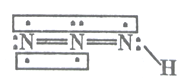
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3,它的酸性类似于醋酸,微弱电离出H+和N3-。试回答下列问题:
(1)从成键原子的电负性角度,HN3中含有的共价键类型为_______________,分子的极性为_____________。
(2)叠氮化物能与Fe3+、Cu2+、Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4,在该配合物中钴显_________价,根据价层互斥理论可知SO42-空间形状为______________,写出钴原子在基态时的核外电子排布式_____________。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是__________(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图![]() ,晶胞中分摊2个钠原子
,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N3-互为等电子体的分子有___________________ (举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:
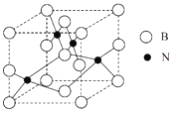
①该晶体的类别为____________晶体。
②晶体中每个N同时吸引________个B。
③设该晶体的摩尔质量为Mg·mol-1,晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B之间的距离为___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题

I. (1)下列说法正确的是________ .
a.XY2和WY2都能溶子水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.依据将NaOH溶液分别滴入MgO2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
Ⅱ. QY2是国际上公认的高效消毒灭菌剂。
(2)实验室中利用KQY3和亚硫酸钠在硫酸存在下制备QY2。写出反应的化学方程式,并用单线桥标明电子转移的方向和数目______________________。
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作I :取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2 = S4O62-+2I-)。
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是_______________________。
②确定操作II完全反应的现象是___________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_________________。
④若水样的体积为1.0L,在操作II中消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中QY2的浓度是__________mol·L-1(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),叙述正确的
4NO(g)+6H2O(g),叙述正确的
A. 单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
B. 达到化学平衡时,4v正(O2)=5v逆(NO)
C. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
D. 达到平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,发生了消去反应的是( )
A.氯苯与NaOH水溶液混合共热
B.乙醇与浓硫酸加热到170℃
C.一氯甲烷与NaOH醇溶液共热
D.CH3CH2Br和浓硫酸共热到170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题
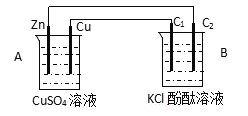
(1)判断装置的名称:A池为___________B池为____________
(2)铜极为______极,电极反应式为________________________,石墨棒C1为____极,电极反应式为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com