
| A. | 淀粉水解 | B. | 酒精挥发 | C. | 水结成冰 | D. | 碘的升华 |
分析 化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.
解答 解:A、淀粉水解是淀粉在稀硫酸的催化作用下,和水反应生成葡萄糖的过程,有新物质生成,故为化学变化,故A正确;
B、酒精挥发是酒精由液态变为气态的过程,是物理状态的变化,无新物质生成,故不是化学变化,故B错误;
C、水结冰是水由液态变为固态,是物理状态的变化,无新物质生成,故不是化学变化,故C错误;
D、升华是物质由固体直接转化为气态的现象,属于物理变化,故D错误;
故选A.
点评 本题考查了物理变化和化学变化的区别与联系,解答本题要分析变化过程中是否有新物质生成,如果有新物质生成就属于化学变化.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NO)=0.0010mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
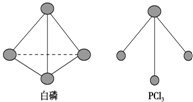 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN溶液的导电性比盐酸的弱 | B. | 1mol/LNaCN溶液呈碱性 | ||
| C. | NaCN可以与盐酸反应 | D. | 1mol/LHCN溶液的pH约为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | B. | 分别加热,观察是否生成沉淀 | ||
| C. | 加入淀粉酶观察是否水解 | D. | 分别加入KI溶液,观察颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com