
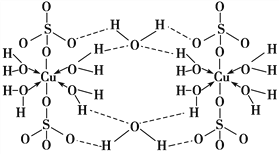
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
【答案】D
【解析】A项,胆矾中H2O中O原子形成2个σ键,O上还有两对孤电子对,H2O中O原子都采取sp3杂化,SO42-中端点氧不发生杂化,A项错误;B项,根据胆矾的结构示意图,氧原子形成极性键、配位键和氢键,氢键不属于化学键,B项错误;C项,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu2+的核外电子排布式为1s22s22p63s23p63d9,Cu2+的价电子排布式为3d9,C项错误;D项,根据胆矾的结构和胆矾可写成[Cu(H2O)4]SO4·H2O,胆矾晶体中水分子有:(1)与Cu2+形成配位键的水分子、(2)与SO42-和配体水分子形成氢键的水分子,由于作用力的不同,胆矾中的水在不同温度下会分步失去,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】按要求回答下列各题:
Ⅰ.下列实验不能成功的是______________
A.为了检验R-X是碘代烷,将R-X与NaOH水溶液共热,经充分反应后冷却,向冷却液中加稀HNO3酸化后,再加AgNO3溶液,观察沉淀颜色
B.为检验淀粉是否水解,将淀粉与少量稀H2SO4共热一段时间,加入新制的Cu(OH)2 ,观察变化
C. 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制取银镜
D.无水乙醇与浓硫酸按1:3的体积比混合快速加热到170℃左右制取乙烯
Ⅱ.有机物M的结构简式为: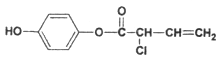 ,则:
,则:
(1)1 mol M最多消耗的H2、Br2、NaOH溶液的比值为_________________;
写出M在酸性(稀硫酸)条件下的水解反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH![]() ⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦ C. ①④⑤⑥⑦⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,利用生成的Fe2+可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如图。下列说法正确的是
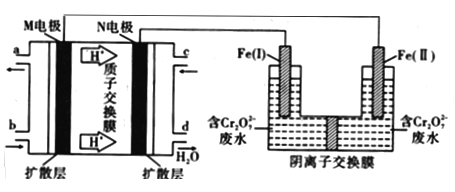
A. 由b口加入物质为O2
B. 燃料电池负极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解过程中,Fe(I)质量减少,Fe(Ⅱ)上有气体产生
D. 电路中每转移6mol电子,最多有1mol Cr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的电离方程式书写正确的是
A. Na2CO3 = Na2+ + CO32
B. NaHCO3 = Na+ + H+ + CO32
C. H2CO3 = 2H+ + CO32
D. Ba(OH)2 = Ba2+ + 2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦ 蔗糖 其中属于电解质的是(填序号)___________,
(2)写出Al2(SO4)3的电离方程式:___________________,
(3)写出NaHSO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题:
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为__________________。
②向Fe(OH)3胶体中加入K2SO4饱和溶液,由于SO42-的作用,使胶体形成了沉淀,这个过程叫做胶体的_______。
③区分胶体和溶液常用的方法叫做__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一
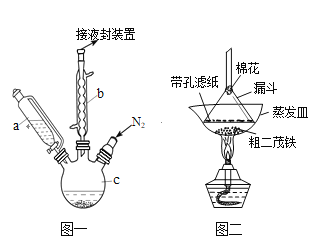
已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6= Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6, 密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是________________________.
(2)步骤①中通入氮气的目的是____________________________________________________.
(3)仪器c的适宜容积应为(选编号):_________
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是__________________________________________________
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为_________;该操作中棉花的作用是______________________________________________________.
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为____________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com