
【题目】1,4-环己二醇可用于生产聚酯纤维,可通过下列路线合成(某些反应的反应物和反应条件未列出):

(1)写出反应①、⑦的化学方程式:
①____________________________________________________________________________;
⑦____________________________________________________________________________。
(2)上述七个反应中属于消去反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_________________________。
【答案】![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl ![]() +2NaOH
+2NaOH![]()
![]() +2NaBr ②④
+2NaBr ②④ 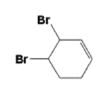 、
、
【解析】
由合成路线可知,反应①为光照条件下的取代反应,反应②为NaOH/醇条件下的消去反应生成A为![]() ,反应③为A与氯气发生加成反应生成B为
,反应③为A与氯气发生加成反应生成B为![]() ,B在NaOH/醇条件下发生消去反应得到
,B在NaOH/醇条件下发生消去反应得到![]() ,反应⑤为溴与
,反应⑤为溴与![]() 的1,4—加成反应,反应⑥为碳碳双键与氢气的加成反应,生成C为
的1,4—加成反应,反应⑥为碳碳双键与氢气的加成反应,生成C为![]() ,反应⑦为C在NaOH/水条件下发生水解反应生成1,4-环己二醇,据此解答。
,反应⑦为C在NaOH/水条件下发生水解反应生成1,4-环己二醇,据此解答。
(1). 反应①为环己烷与氯气在光照条件下发生取代反应生成![]() ,化学方程式为:
,化学方程式为:![]() +Cl2
+Cl2![]()
![]() +HCl,反应⑦为
+HCl,反应⑦为![]() 在NaOH/水条件下发生水解反应生成1,4-环己二醇,化学方程式为:
在NaOH/水条件下发生水解反应生成1,4-环己二醇,化学方程式为:![]() +2NaOH
+2NaOH![]()
![]() +2NaBr,故答案为:
+2NaBr,故答案为:![]() +Cl2
+Cl2![]()
![]() +HCl;
+HCl;![]() +2NaOH
+2NaOH![]()
![]() +2NaBr;
+2NaBr;
(2). 由上述分析可知,上述七个反应中属于消去反应的有②和④,故答案为:②④;
(3). 反应⑤为溴与![]() 发生的1,4—加成反应,在反应时,
发生的1,4—加成反应,在反应时,![]() 可能和溴发生1,2—加成反应生成
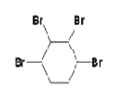
可能和溴发生1,2—加成反应生成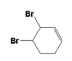 ,也可能两个C=C都与溴发生加成反应生成
,也可能两个C=C都与溴发生加成反应生成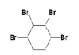 ,故答案为:
,故答案为: 、
、 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚具有微弱的酸性,可利用电场促使C6H5O-定向移动、脱离废水,并富集回收。电渗析装置示意图如下。下列说法不正确的是

A. 苯酚的电离方程式为:
B. A、B分别为离子交换膜,其中A是阴离子交换膜
C. 电解过程中,阳极室的pH增大
D. 当通过线路中的电子数目为0.1 NA时,有含0.1mol C6H5O-的废水被处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:

(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________。
(2)下列三种情况下,离子方程式与(1)相同的是____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液中显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
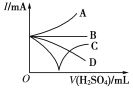
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右图中的___曲线表示(填序号)。
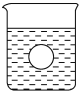
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将____________。
Ⅱ.某地甲、乙两厂排放污水,污水中含有下列8种离子中的4种:Ag+、Ba2+、Fe3+ 、Na+、Cl-、SO42-、NO3-、OH-(两厂所排污水不含相同离子)。两厂单独排放都会造成严重的水污染(其中甲厂的污水是碱性的),如将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低。关于两厂所排污水中所含的4种离子,你认为应该是:甲厂:________;乙厂________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl制备碳酸氢钠。下列实验装置能达到实验目的的是

A. 用装置甲制取氨气 B. 用装置乙制取二氧化碳
C. 用装置丙制取碳酸氢钠 D. 用装置丁分离碳酸氢钠与母液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列的是____。
①0.5 mol氨气 ②标准状况下22.4 L氦气 ③4℃时9 mL水 ④0.2 mol磷酸钠
(2)某双原子分子构成的气体,其摩尔质量为Mg/mol,该气体质量为mg,阿伏加德罗常数为NA,则:
①该气体的物质的量为____mol
②该气体在标准状况下的体积为____L
③该气体在标准状况下的密度为____g/L
④该气体所含原子总数为____个
⑤该气体的一个分子的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com