
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)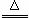 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
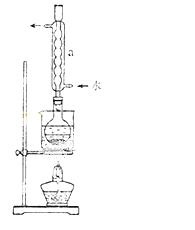
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化: 。
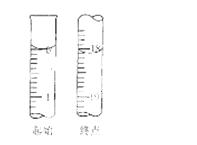
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到
2BaO(s)+O2(g)达到
平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
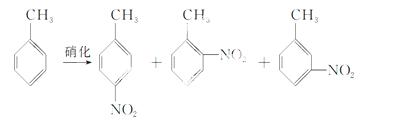
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶剂中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经 分离提纯得到对硝基甲苯。
分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________。
(3)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
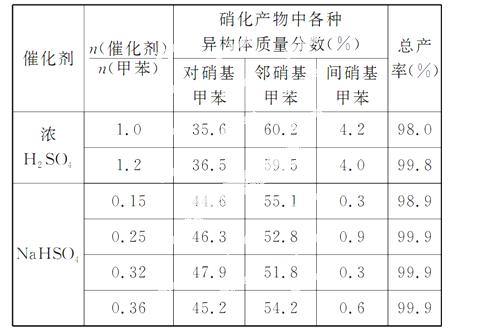
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是__________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
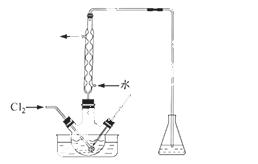
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32—+2IO3—+2H+ I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 | 验证火柴头含有氯元素 |
| C | 在淀粉-KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝的食品添加剂,逐步转换为无铝的食品添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)和碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

实验过程:
①按上图组装仪器,检查装置的气密性;
②将试样m1 g放入硬质玻璃管中,装置B、C、D中药品如上 图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)装置B的作用为
________________________________________________________________________;
装置C的作用为
________________________________________________________________________。
(3)实验过程中通入N2的目的为
________________________________________________________________________。
(4)用下列各项所提供的数据能计算出ω(NaHCO3)的是________(填选项字母)。
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,写出ω(NaHCO3)的计算式。
________(填“能”或“不能”),________(若不能,此空不作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A. 容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B. 平衡时,两个容器中XY3的物质的量浓度相等
C. 器②中反应达到平衡时吸收的热量为Q
D. 容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为________。
(3)已知C、E两种元素合成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
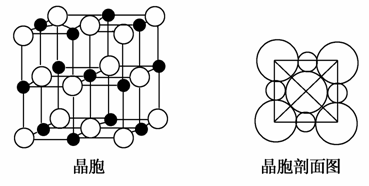
晶胞中距离一个B+最近的B+有________个。
若晶体密度为ρg·cm-3,阿伏加德罗常的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com