
分析 (1)同种非金属元素之间形成非极性共价键,不同非金属元素形成极性键;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,注意氯化铝中只含共价键,铵盐中含有离子键.
解答 解:(1)①H2O2中即含O-O非极性键又含H-O极性键;
②NaOH中含离子键和H-O极性共价键;
③NH4NO3中含离子键和N-H和N-O极性共价键;
④CH2=CH2中即含C-C非极性键又含H-C极性键;
所以存在非极性键的物质是①④,故答案为:①④;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,所以
①H2O2中只含共价键;
②NaOH中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键;
③NH4NO3中铵根离子和硝酸根离子之间存在离子键,氮原子和氢原子之间、氮原子和氧原子之间存在共价键;
④CH2=CH2中只含共价键;
所以既存在离子键又存在共价键的是②③,
故答案为:②③.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:填空题
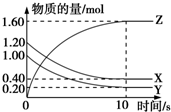 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的原子失去电子能力比镁弱 | |
| B. | 砹(At)的氢化物不稳定 | |
| C. | 硫化氢比硒(Se)化氢稳定 | |
| D. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M位于元素周期表的第VA族 | B. | M的氢化物的水溶液呈酸性 | ||
| C. | MO3-中的M元素只能被还原 | D. | M2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 现象 | 结论 |
| A | 金属钠 | 有气体产生 | 含羟基或羧基或羟基、羧基 |
| B | 银氨溶液 | 产生银镜 | 含有醛基 |
| C | 碳酸氢钠溶液 | 产生气泡 | 含有羧基 |
| D | 溴水 | 溶液褪色 | 含有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
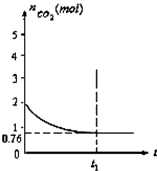 一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com