
| A. | 23Na37Cl中质子数和中子数之比是7:8 | |
| B. | KIO3和NaHSO3都是强电解质 | |
| C. | KIO3作氧化剂发生氧化反应 | |
| D. | 生成1mo1KI时,转移6mo1电子 |
分析 A.原子中,质子数+中子数=质量数;
B.KIO3和NaHSO3在水溶液中或熔化状态下均能完全电离;
C.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价降低;
D.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价由+5降低到-1.
解答 解:A.原子中,质子数+中子数=质量数,23Na37Cl中质子数和中子数之比是(11+17):(12+20)=7:8,故A正确;
B.KIO3和NaHSO3在水溶液中或熔化状态下均能完全电离,则KIO3和NaHSO3都是强电解质,故B正确;
C.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价降低,则KIO3作氧化剂发生还原反应,故C错误;
D.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价由+5降低到-1,所以生成1mo1KI时,转移6mo1电子,故D正确;
故选C.
点评 本题以碘及其化合物的性质考查物质的分类、氧化还原反应及原子的构成,综合性较强,注重基础知识和高频考点的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
捕碳技术是指从空气中捕获CO2的技术。目前NH3已经被用作工业捕碳剂。下列物质中不能作为捕碳剂的是
A.Na2CO3 B.H2NCH2CH2NH2 C.(NH4)2CO3 D.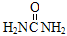
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
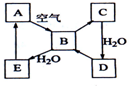 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
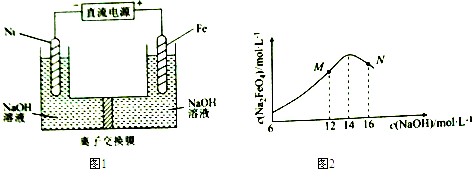
| A. | 制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O | |
| B. | 电解过程中,须将阴极产生的气体及时排出 | |
| C. | MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成 | |
| D. | 图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有HC1O存在 | |
| B. | 溶液呈黄绿色,且有刺激性气味,说明有C12分子存在 | |
| C. | 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有C1-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com