
����Ŀ��1000mLij����Һ�г�����0.2molL��1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����Br����CO32����HCO3����SO32����SO42�� |
�ֽ�������ʵ������������Լ�����������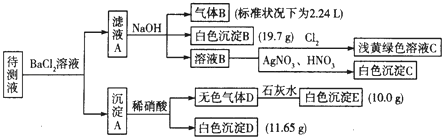
��1��д�����ɰ�ɫ����B�����ӷ���ʽ�� ��
��2������ɫ����D�ǵ�һ���壺 �ٽ������ӵ����ʵ���Ũ�������±��У�һ�������ڵ��0��������ȷ�������������
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/molL��1 |
���ж�ԭ��Һ��K+�Ƿ���ڣ������ڣ��������ʵ���Ũ�ȵ���Сֵ���������ڣ���˵�����ɣ� ��
��3������ɫ����D�ǻ�����壬����Һ��һ�����е��������� ��
���𰸡�
��1��HCO3��+Ba2++OH��=BaCO3��+H2O
��2�����ڣ�K+������СŨ��Ϊ0.1mol/L
��3��CO32����HCO3����SO32��
���������⣺����Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32����SO32����SO42�� �� ������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32�� �� ���ܴ���SO32����SO42���е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+�� ��ҺA����Ba2+ �� ���������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3�� �� һ��������Fe3+ �� ����BΪNH3 �� ��ɫ����BΪBaCO3 �� ��ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br�� �� ��ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl�� �� ���ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl������1��������������֪����ɫ����BΪ̼�ᱵ������HCO3����Ba2+��OH����Ӧ���ɣ���Ӧ���ӷ���ʽΪ��HCO3��+Ba2++OH��=BaCO3��+H2O��
�ʴ�Ϊ��HCO3��+Ba2++OH��=BaCO3��+H2O����2����������������֪������ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� ��
����ɫ����D�ǵ�һ���壬��DΪCO2 �� EΪCaCO3 �� ��Һ�к���CO32�� �� ��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ��û��SO32�� �� һ������SO42�� ��
B��̼�ᱵ�������ʵ���= ![]() =0.1mol����n��HCO3����=0.1mol����c��HCO3����=
=0.1mol����n��HCO3����=0.1mol����c��HCO3����= ![]() =0.1mol/L��
=0.1mol/L��
E��̼��ƣ������ʵ���= ![]() =0.1mol����n��CO32����=0.1mol����c��CO32����=
=0.1mol����n��CO32����=0.1mol����c��CO32����= ![]() =0.1mol/L��
=0.1mol/L��
D�����ᱵ�������ʵ���= ![]() =0.05mol����n��SO42����=0.05mol����c��SO42����=
=0.05mol����n��SO42����=0.05mol����c��SO42����= ![]() =0.05mol/L��
=0.05mol/L��
�ʴ�Ϊ��
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/molL��1 | �� | 0 | 0.1 | 0.1 | 0 | 0.05 |
��n��NH4+��=n��NH3��= ![]() =0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3����=0.1mol/L��c��CO32����=0.1mol/L��c��SO42����=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��=0.4mol/L��0.3mol��L=0.1mol/L��
=0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3����=0.1mol/L��c��CO32����=0.1mol/L��c��SO42����=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��=0.4mol/L��0.3mol��L=0.1mol/L��
�ʴ�Ϊ�����ڣ�K+������СŨ��Ϊ0.1mol/L����3����������������֪����Һ��һ������CO32����HCO3�� �� ����ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� ��
����ɫ����D�ǻ�����壬ֻ��ΪCO2��NO������壬��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ������SO32�� �� ����ȷ���Ƿ���SO42�� �� ����Һ��һ�����е���������CO32����HCO3����SO32�� ��
�ʴ�Ϊ��CO32����HCO3����SO32�� ��
��1������Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32����SO32����SO42�� �� ������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32�� �� ���ܴ���SO32����SO42���е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+��
��ҺA����Ba2+ �� ���������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3�� �� һ��������Fe3+ �� ����BΪNH3 �� ��ɫ����BΪBaCO3 �� ��ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br�� �� ��ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl�� �� ���ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl������2������ɫ����D�ǵ�һ���壬��DΪCO2 �� EΪCaCO3 �� ��Һ�к���CO32�� �� ��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ��û��SO32�� �� һ������SO42�� �� ����B��̼�ᱵ����E��̼��ƣ������ᱵ�����ʵ��������������غ��������ӵ�Ũ�ȣ�
���ݵ���غ��ж��Ƿ��м����ӣ�����Һ����K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ���㣻��3����Һ��һ������CO32����HCO3�� �� ����ȷ��ԭ��Һ���Ƿ���Cl�� �� ��Һ��һ��û��Br�� �� ����ɫ����D�ǻ�����壬ֻ��ΪCO2��NO������壬��ɫ����Dֻ��ΪBaSO4 �� ��Һ��һ������SO32�� �� ����ȷ���Ƿ���SO42�� ��


 �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�������̻�ɫ���ױ���������ȣ�
��1����仯�ɱ���Ϊ������ƽ������ѧ����ʽ����˫���ű�ʾ�˷�Ӧת�Ƶĵ�����Ŀ������
��ƽ��KClO3+HCl��Ũ��=KCl+ClO2��+Cl2��+H2O
˫���ţ�
��2��Ũ�����ڷ�Ӧ����ʾ�����������������ţ�
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��3���������� �� ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѷ���Ҫ��Ļ�ѧ����ʽ����ĸ�������пհ״���
A����NH4��2SO3 ![]() 2NH3��+H2O+SO2��
2NH3��+H2O+SO2��
B��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O
C��2C+SiO2 ![]() Si+2CO��
Si+2CO��
D��NH4NO3 ![]() N2O��+2H2O
N2O��+2H2O
E��Na2CO3+CO2+H2O�T2NaHCO3
F��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�ټ����ڷֽⷴӦ����������ԭ��Ӧ����
�����ڷֽⷴӦ��������������ԭ��Ӧ����
�����ڻ��Ϸ�Ӧ��������������ԭ��Ӧ����
�ܲ��������ֻ�����Ӧ���͵�������ԭ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D�����й����ʻ�ṹ��Ϣ�����ʾ��
Ԫ�� | A | B | C | D |
�й����ʻ�ṹ��Ϣ | ���γ�+7�۵Ļ����� | ��̬ԭ�Ӻ���s�ܼ��ϵĵ�������p�ܼ��ϵĵ�������2�� | ��Ԫ���γɵĵ���ͨ��������ͬ�������壬����һ�ֵ��ʷֲ��ڸ߿գ�������ֹ������������ | ͨ����������γɶ����������ȶ���˫ԭ���ӷ��� |
��1��Bλ��Ԫ�����ڱ��е����ڵ��壬Ԫ��B��Ԫ��C��ȣ��縺�Խ�С������дԪ�����ƣ���������BC2������B�ĵ��ʾ���������ͬһ���ͻ�ͬ���ͣ���
��2��д��Ԫ��C�ĺ���10�����ӵ�һ�ֺ��ط��� �� B��һ���⻯��B2H2�����ЦҼ���м�����Ŀ֮��Ϊ ��
��3��C��D������ɶ�����ʽ�Ļ��������D2C5�ܹ�ˮ��Ӧ��������X��д������X��ϡ��Һ�������Fe��Ӧ�����ӷ���ʽ��
��4��A�����{��������Ϊ��ɫҺ�壬9.15g��������������ˮ��ϣ��õ�һ��ϡ��Һ�����ų�QKJ�������÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֱ���þƾ��Ƽ��ȵ���
����Ͳ�ڱ�������ձ����Թܢ���ƿ�������������
A. �ڢۢܢޢ� B. �ۢܢޢ� C. �ܢޢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӳ����������Σ���ͼ��ʾ�����ڸߵ�ѹ���������õľ�Ե�ԣ��ڵ�����ҵ�������Ź㷺����;������ɢ�������л���������ЧӦ�������й�����������Ʋ���ȷ���ǣ� �� 
A.����������ȼ�����ɶ�������
B.���������и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ
C.������������е�S��F�����ǦҼ����Ҽ��������ܶ����
D.������������Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���Ԫ�������ɵı�����ʽ������˵����ȷ����
A. VA�弰����������Ԫ�ؿ����ҵ�����ũҩ����Ԫ��
B. �ڽ�����ǽ��������߸���Ѱ�������
C. ��IAԪ��ȫ���ǽ���Ԫ��
D. ���ڹ���Ԫ����Ѱ�Ұ뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��ѹ������Է�ֹ̿���ό
B.ʯ���ѻ���Ŀ����������͵IJ���������
C.ʯ�͵ij�ѹ����ѹ�����Լ�ú�ĸ����������仯
D.����������Ҫ��Դ��ʯ�͵Ĵ�������ú�ĸ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com